题目内容
有关元素X、Y、Z、D、E的信息如下:| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物对应的水化物,能按1:1电离出电子数相等的阴、阳离子 |
| E | 其单质有多种同素异形体,一种为自然界中硬度最大 |
(2)写出D的最高价氧化物的水化物电离出的阴离子的电子式______;
(3)D2ZX3的溶液与Y的单质可能发生反应,其反应的离子方程式为______;
(4)用化学符号表示D2EX3的水溶液中各离子的浓度关系(列等式)______;
(5)已知ZX2与X2可发生反应:2ZX2(g)+X2(g)?2ZX3(g)△H<0;
当反应达到平衡时不断改变条件(不改变ZX2、X2、ZX3的量),反应速率随时间的变化如图:
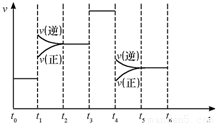
其中表示平衡混合物中ZX3含量最高的一段时间是______;如t~t1平衡常数为K1,t2~t3平衡常数为K2,则K1______K2
(填“大于”、“等于”或“小于”).
【答案】分析:X的主要化合价是-2价,故X属于第ⅥA元素,X的原子半径为0.074nm,X为氧元素;
Y所在主族序数与所在周期序数之差为4,只有Cl元素符合,所以Y是氯元素;
Z原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰,所以Z是钾元素;
D最高价氧化物对应的水化物,能按1:1电离出电子数相等的阴、阳离子,说明D的最高价氧化物的水化物是碱,能按1:1电离出电子数相等的阴、阳离子,说明D是第ⅠA族的元素,该元素为常见元素,应为钠元素;
E其单质有多种同素异形体,一种为自然界中硬度最大,所以E是碳元素;
(1)根据离子结构示意图画出离子结构示意图;
(2)根据阴离子电子式的书写规则书写;
(3)亚硫酸根离子具有还原性,氯气具有氧化性,所以亚硫酸根离子和氯气能发生氧化还原反应;
(4)根据溶液中阴阳离子电荷守恒分析;
(5)根据平衡的移动判断平衡混合物中ZX3含量最高的时间段,根据温度对化学平衡的影响判断平衡常数的大小.
解答:解:X的主要化合价是-2价,故X属于第ⅥA元素,X的原子半径为0.074nm,X为氧元素;
Y所在主族序数与所在周期序数之差为4,只有Cl元素符合,所以Y是氯元素;
Z原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰,所以Z是钾元素;
D最高价氧化物对应的水化物,能按1:1电离出电子数相等的阴、阳离子,说明D的最高价氧化物的水化物是碱,能按1:1电离出电子数相等的阴、阳离子,说明D是第ⅠA族的元素,该元素为常见元素,应为钠元素;
E其单质有多种同素异形体,一种为自然界中硬度最大,所以E是碳元素;
(1)氯原子得一个电子使最外层达到8个电子稳定结构,离子结构示意图为: ,故答案为:
,故答案为: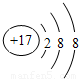 ;
;
(2)书写阴离子电子式时,要用方括号括起来,写出电荷和电性,氢氧根离子的电子式为: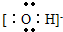 ,故答案为:
,故答案为: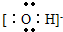 ;
;
(3)亚硫酸根离子具有还原性,氯气有强氧化性,所以亚硫酸根离子和氯气能发生氧化还原反应生成盐酸和硫酸,
故答案为:SO32-+Cl2+H2O=SO42-+2Cl-+2H+;
(4)该溶液中存在的阴离子有碳酸根离子、碳酸氢根离子和氢氧根离子,阳离子有钠离子和氢离子,溶液中阴阳离子电荷守恒,得c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),
故答案为:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-);
(5)2ZX2(g)+X2(g)?2ZX3(g)△H<0,该反应是反应前后气体体积减小的放热反应,
t~t1时间段,正逆反应速率相等,是化学平衡状态,平衡不移动;t1~t2时间段,逆反应速率降低,正反应速率增大,平衡向逆反应方向移动,生成物的浓度降低;t2~t3时间段,正逆反应速率相等,是化学平衡状态,平衡不移动;t3~t4时间段,正逆反应速率相等,是化学平衡状态,平衡不移动,但反应速率大于原来的反应速率,所以是向容器中加入了催化剂;t4~t5时间段,逆反应速率降低,正反应速率增大,平衡向逆反应方向移动,生成物的浓度减低;t5~t6时间段,正逆反应速率相等,是化学平衡状态,平衡不移动.所以表示平衡混合物中ZX3含量最高的一段时间是t~t1;t~t1平衡常数为K1,t2~t3平衡常数为K2,t~t1与t1~t2相比,正逆反应速率都增大且不相等,可能是压强增大或温度升高,但t1~t2逆反应速率逐渐减小,正反应速率逐渐增大,平衡向逆反应方向移动,该反应是一个气体体积减小且放热的反应,所以只能是升高温度导致平衡向逆反应方向移动;t2~t3时间段,正逆反应速率相等,是化学平衡状态,平衡不移动,所以;t1~t2和t2~t3时间段温度相同,该反应是放热反应,升高温度,平衡向逆反应方向移动,导致生成物的浓度降低,反应物的浓度升高,所以平衡常数减小,所以K1大于 K2.
故答案为:t~t1;大于.
点评:本题考查了元素的判断、离子结构示意图的书写、电子式的书写、氧化还原反应等知识点,难度不大,会根据外界条件对化学平衡的影响来分析图象是解(5)题的关键.
Y所在主族序数与所在周期序数之差为4,只有Cl元素符合,所以Y是氯元素;
Z原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰,所以Z是钾元素;
D最高价氧化物对应的水化物,能按1:1电离出电子数相等的阴、阳离子,说明D的最高价氧化物的水化物是碱,能按1:1电离出电子数相等的阴、阳离子,说明D是第ⅠA族的元素,该元素为常见元素,应为钠元素;
E其单质有多种同素异形体,一种为自然界中硬度最大,所以E是碳元素;
(1)根据离子结构示意图画出离子结构示意图;
(2)根据阴离子电子式的书写规则书写;
(3)亚硫酸根离子具有还原性,氯气具有氧化性,所以亚硫酸根离子和氯气能发生氧化还原反应;
(4)根据溶液中阴阳离子电荷守恒分析;
(5)根据平衡的移动判断平衡混合物中ZX3含量最高的时间段,根据温度对化学平衡的影响判断平衡常数的大小.
解答:解:X的主要化合价是-2价,故X属于第ⅥA元素,X的原子半径为0.074nm,X为氧元素;
Y所在主族序数与所在周期序数之差为4,只有Cl元素符合,所以Y是氯元素;
Z原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰,所以Z是钾元素;
D最高价氧化物对应的水化物,能按1:1电离出电子数相等的阴、阳离子,说明D的最高价氧化物的水化物是碱,能按1:1电离出电子数相等的阴、阳离子,说明D是第ⅠA族的元素,该元素为常见元素,应为钠元素;
E其单质有多种同素异形体,一种为自然界中硬度最大,所以E是碳元素;
(1)氯原子得一个电子使最外层达到8个电子稳定结构,离子结构示意图为:
 ,故答案为:
,故答案为: ;
;(2)书写阴离子电子式时,要用方括号括起来,写出电荷和电性,氢氧根离子的电子式为:
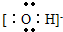 ,故答案为:
,故答案为: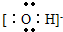 ;
;(3)亚硫酸根离子具有还原性,氯气有强氧化性,所以亚硫酸根离子和氯气能发生氧化还原反应生成盐酸和硫酸,
故答案为:SO32-+Cl2+H2O=SO42-+2Cl-+2H+;
(4)该溶液中存在的阴离子有碳酸根离子、碳酸氢根离子和氢氧根离子,阳离子有钠离子和氢离子,溶液中阴阳离子电荷守恒,得c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),
故答案为:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-);
(5)2ZX2(g)+X2(g)?2ZX3(g)△H<0,该反应是反应前后气体体积减小的放热反应,
t~t1时间段,正逆反应速率相等,是化学平衡状态,平衡不移动;t1~t2时间段,逆反应速率降低,正反应速率增大,平衡向逆反应方向移动,生成物的浓度降低;t2~t3时间段,正逆反应速率相等,是化学平衡状态,平衡不移动;t3~t4时间段,正逆反应速率相等,是化学平衡状态,平衡不移动,但反应速率大于原来的反应速率,所以是向容器中加入了催化剂;t4~t5时间段,逆反应速率降低,正反应速率增大,平衡向逆反应方向移动,生成物的浓度减低;t5~t6时间段,正逆反应速率相等,是化学平衡状态,平衡不移动.所以表示平衡混合物中ZX3含量最高的一段时间是t~t1;t~t1平衡常数为K1,t2~t3平衡常数为K2,t~t1与t1~t2相比,正逆反应速率都增大且不相等,可能是压强增大或温度升高,但t1~t2逆反应速率逐渐减小,正反应速率逐渐增大,平衡向逆反应方向移动,该反应是一个气体体积减小且放热的反应,所以只能是升高温度导致平衡向逆反应方向移动;t2~t3时间段,正逆反应速率相等,是化学平衡状态,平衡不移动,所以;t1~t2和t2~t3时间段温度相同,该反应是放热反应,升高温度,平衡向逆反应方向移动,导致生成物的浓度降低,反应物的浓度升高,所以平衡常数减小,所以K1大于 K2.
故答案为:t~t1;大于.
点评:本题考查了元素的判断、离子结构示意图的书写、电子式的书写、氧化还原反应等知识点,难度不大,会根据外界条件对化学平衡的影响来分析图象是解(5)题的关键.

练习册系列答案
相关题目


 有关元素X、Y、Z、D、E的信息如下
有关元素X、Y、Z、D、E的信息如下