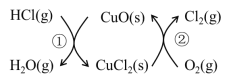
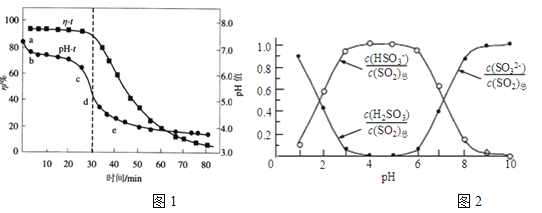
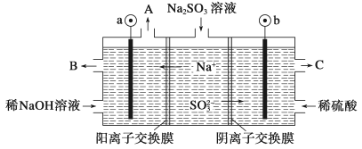
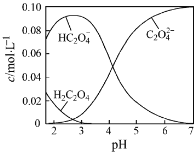
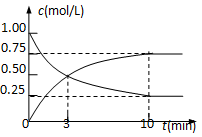
题目内容
【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
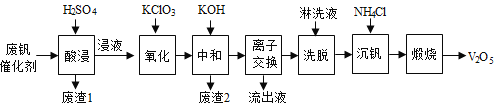
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为________________________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为_____________mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中。“废渣2”中含有______________。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124![]() R4V4O12+4OH(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”、“碱”或“中”)。
R4V4O12+4OH(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”、“碱”或“中”)。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
【答案】(1)V2O5+2H+=2VO2++H2O;SiO2;
(2)0.5;(3)Fe(OH)3、Al(OH)3;
(4)碱;(5)2NH4VO3![]() V2O5+H2O+2NH3↑。
V2O5+H2O+2NH3↑。
【解析】
试题分析:(1)V2O5→VO2+,化合价没有发生变化,则离子反应方程式为:V2O5+2H+=2VO2++H2O;根据废钒催化剂的成分,只有SiO2属于酸性氧化物,不溶于稀硫酸,因此滤渣为SiO2;
(2)根据得失电子数目守恒,3×(5-4)=n(KClO3)×[5-(-1)],解得n(KClO3)=0.5mol,;
(3)中和的目的是除去Fe3+和Al3+,因此滤渣为Fe(OH)3和Al(OH)3;
(4)洗脱中溶液应是V4O124-,平衡向逆反应方向进行,因此淋洗液呈现碱性;
(5)根据流程图,铵盐不稳定,受热易分解成氨气,偏钒酸铵的煅烧发生化学反应方程式为:2NH4VO3![]() V2O5+H2O+2NH3↑。
V2O5+H2O+2NH3↑。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】(Ⅰ)俄美科学家联合小组宣布合成出114号元素(Fl)的一种同位素,该原子的质量数是289,试回答下列问题:
(1)该元素在周期表中位于第___________周期,___________族,属于金属元素还是非金属元素? ___________。
(2)该原子核内中子数为___________;
(3)如果该元素存在最高价氧化物对应的水化物,请写出其化学式___________;
(Ⅱ)下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:
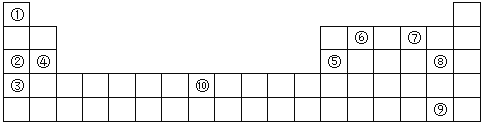
(1)②③④三种元素最高价氧化物的水化物碱性由强到弱的顺序是___________(填化学式)。
(2)10种元素中,原子半径最小的是___________(填序号)。
(3)元素⑦的氢化物与⑧的单质反应的离子方程式为___________;
(4)元素②和⑤的最高价氧化物的水化物相互反应的化学方程式为___________;
(5)元素⑩的原子序数为___________,其单质与⑦的氢化物高温下反应的化学方程式为___________;
(6)单质⑨易溶于⑥与⑧形成的化合物中,所得溶液颜色为___________色。
(Ⅲ)判断以下叙述正确的是___________
部分短周期元素的原子半径及主要化合价
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.L2+、R2-的核外电子数相等
B.单质与稀盐酸反应的速率L<Q
C.M与T形成的化合物一定具有两性
D.氢化物的沸点为HnT>HnR
E.T与R形成的TR2、TR3均为共价化合物
F. Q与M的单质均能与盐酸、NaOH溶液反应放出氢气