题目内容
【题目】可逆反应2A(g)+3B(g) ![]() 2C(g)+D(g)在四种不同条件下的反应速率分别为( )。
2C(g)+D(g)在四种不同条件下的反应速率分别为( )。
①v(A)=0.5 mol/(L·min)
②v(B)=0.6 mol/(L·min)
③v(C)=0.35 mol/(L·min)
④v(D)=0.4 mol/(L·min)
则该反应在不同条件下反应速率最快的是( )
A. ① B. ② C. ③ D. ④
【答案】D
【解析】
试题分析:对于反应:2A+3B═2C+D,都转化B表示的速率进行比较:
A.v(A)=0.5 mol/(Lmin),则v(B)=![]() v(A)=
v(A)=![]() ×0.5 mol/(Lmin)=0.75 mol/(Lmin);
×0.5 mol/(Lmin)=0.75 mol/(Lmin);
B.v(B)=0.6 mol/(Lmin);
C.v(C)=0.35 mol/(Lmin),则v(B)=![]() v(C)=
v(C)=![]() ×0.35 mol/(Lmin)=0.525 mol/(Lmin);D.v(D)=0.4 mol/(Lmin),则v(B)=3v(D)=3×0.4 mol/(Lmin)=1.2 mol/(Lmin);故反应速率最快的是v(D)。答案选D。
×0.35 mol/(Lmin)=0.525 mol/(Lmin);D.v(D)=0.4 mol/(Lmin),则v(B)=3v(D)=3×0.4 mol/(Lmin)=1.2 mol/(Lmin);故反应速率最快的是v(D)。答案选D。

【题目】下列各组元素的性质递变情况错误的是( )
A. Li、C、O原子最外层电子数依次增加
B. P、S、Cl元素最高正化合价依次升高
C. N、O、F原子半径依次增大
D. Li、Na、K的金属性依次增强
【题目】高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
![]()
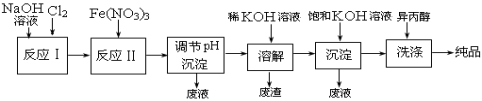
①反应I的化学方程式为 。
②反应II的离子方程式为 。
③加入饱和KOH溶液的目的是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ;__ __。(用文字表述)
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为 。
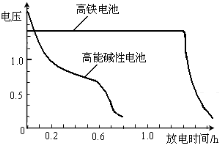
(4)高铁电池是正在研制中的可充电干电池,右图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ; 。