题目内容
【题目】已知A是一种重要的基本化工原料,能使溴的四氯化碳溶液褪色,其产量常用于衡量一个国家石油化工发展水平的标志,也是一种植物生长调节剂。下列是有机物A~G之间的转化关系:

请回答下列问题:
(1)B的官能团的名称是 ,G是一种高分子化合物,其链节是 。
(2)由A生成F的反应类型是 反应,B生成C的化学方程式是 。
(3)B和D反应生成E的化学方程式是 ,该反应类型是反应 。
(4)工业上用30吨D与46吨B反应,如果实际产率是理论产率的67%,则实际可得到的E的质量是 (保留四位有效数字)。
【答案】(1)羟基(有错别字不给分)(1分) —CH2—CH2—(1分)
(2)加成(1分);2CH3CH2OH+O2![]() 2CH3CHO+2H2O(2分);
2CH3CHO+2H2O(2分);
(3)CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O(2分)
CH3COOCH2CH3+H2O(2分)
酯化或取代(有错别字不给分)(1分)
(4)29.48吨(2分)(不写单位扣1分)
【解析】
试题分析:A是一种重要的基本化工原料,能使溴的四氯化碳溶液褪色,其产量常用于衡量一个国家石油化工发展水平的标志,也是一种植物生长调节剂,则A是乙烯,结构简式是CH2=CH2,乙烯与水发生加成反应产生的B是CH3CH2OH;CH3CH2OH在Cu作催化剂时被氧化产生C是乙醛,结构简式是CH3CHO;乙醇被酸性高锰酸钾溶液氧化产生D是乙酸CH3COOH;乙醇与乙酸在浓硫酸作用下,加热发生酯化反应产生E:乙酸乙酯;乙烯与HCl发生加成反应产生F:氯乙烷CH3CH2Cl;在一定条件下发生加聚反应产生G聚乙烯:![]() 。(1)B是乙醇,官能团是羟基,G是一种高分子化合物聚乙烯,其链节是—CH2—CH2—。(2)由A生成F的反应类型是加成反应,乙醇被催化氧化产生乙醛的化学方程式是2CH3CH2OH+O2
。(1)B是乙醇,官能团是羟基,G是一种高分子化合物聚乙烯,其链节是—CH2—CH2—。(2)由A生成F的反应类型是加成反应,乙醇被催化氧化产生乙醛的化学方程式是2CH3CH2OH+O2![]() 2CH3CHO+2H2O。(3)乙醇与乙酸在浓硫酸作用下,加热发生酯化反应产生乙酸乙酯和水,酯化反应也是取代反应。B和D反应生成E的化学方程式是CH3CH2OH+ CH3COOH
2CH3CHO+2H2O。(3)乙醇与乙酸在浓硫酸作用下,加热发生酯化反应产生乙酸乙酯和水,酯化反应也是取代反应。B和D反应生成E的化学方程式是CH3CH2OH+ CH3COOH![]() CH3COOCH2CH3+H2O。(4)乙酸的相对分子质量是60,, 30吨乙酸的物质的量是n(CH3COOH)=30×107g÷60g/mol=5×106mol,乙醇的相对分子质量是46,46吨乙醇的物质的量是n(CH3CH2OH)=46×106g÷46tg/mol=1×106mol,由于二者反应的物质的量的比是1:1,可见乙醇过量,如果实际产率是理论产率的67%,则反应的乙酸的物质的量是n(CH3COOH)= 5×105mol×67%=3.35×105mol,实际可得到的乙酸乙酯的质量是m(CH3COOCH2CH3)= 3.35×106mol×88g/mol= 2.948×107g= 29.48×106g= 29.48吨。
CH3COOCH2CH3+H2O。(4)乙酸的相对分子质量是60,, 30吨乙酸的物质的量是n(CH3COOH)=30×107g÷60g/mol=5×106mol,乙醇的相对分子质量是46,46吨乙醇的物质的量是n(CH3CH2OH)=46×106g÷46tg/mol=1×106mol,由于二者反应的物质的量的比是1:1,可见乙醇过量,如果实际产率是理论产率的67%,则反应的乙酸的物质的量是n(CH3COOH)= 5×105mol×67%=3.35×105mol,实际可得到的乙酸乙酯的质量是m(CH3COOCH2CH3)= 3.35×106mol×88g/mol= 2.948×107g= 29.48×106g= 29.48吨。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
![]()
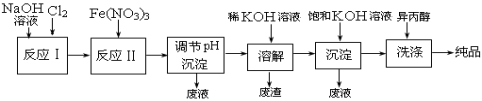
①反应I的化学方程式为 。
②反应II的离子方程式为 。
③加入饱和KOH溶液的目的是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ;__ __。(用文字表述)
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为 。
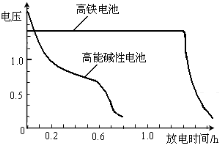
(4)高铁电池是正在研制中的可充电干电池,右图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ; 。