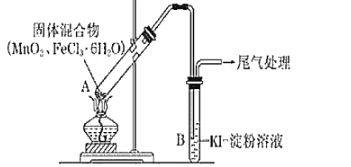
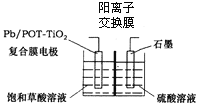
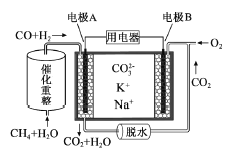
题目内容
【题目】下列微粒半径大小比较正确的是( )
A. N![]() <M
<M![]() <
<![]() <
<![]() B. N
B. N![]() >M
>M![]() >
>![]() >C
>C![]() C. Na>Mg>Al>SD. Cs<Rb<K<Na
C. Na>Mg>Al>SD. Cs<Rb<K<Na
【答案】C
【解析】
粒子的电子层越多,粒子的半径越大;电子层相同时,粒子的核电荷数越大,粒子的半径越小,据此结合元素周期律知识进行解答。
A项中K+的电子层数比Na+、Mg2+、O2-多,再根据核外电子排布相同的离子半径比较规律可知,K+>O2->Na+>Mg2+,故A项错误;
B项中S2-和Cl-的电子层数比Na+和Mg2+多,再根据核外电子排布相同的离子半径比较规律可知,S2->Cl->Na+>Mg2+,故B项错误;
C项属于同周期元素的原子,核电荷数越大,半径越小,Na>Mg>Al>S,故C项正确;
D项是同主族元素原子,核电荷数越大,半径越大,Cs>Rb>K>Na,故D项错误。
故答案选C。

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目