题目内容
【题目】铁和钴是重要的过渡元素。
(1)钴位于元素周期表中第___族,基态钴原子中未成对电子的个数为_____。
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中中心离子Fe3+的核外价电子排布式为___;尿素分子中氮原子的杂化方式是___,尿素中所含非金属元素的电负性由大到小的顺序是___。
(3)Co(NH3)5BrSO4可形成两种结构的钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:
在第一种配合物溶液中加硝酸银溶液产生白色沉淀。
在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀,则第二种配合物的配体为_____。
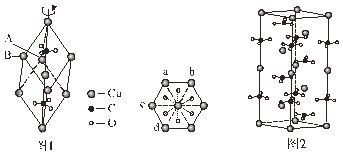
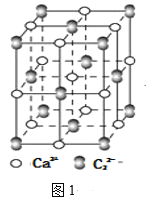
(4)离子化合物CaC2的一种晶体结构如图1所示,从钙离子看,属于____堆积,其配位数是_____;一个晶胞中平均含有的π键的个数为_____。
(5)科学研究结果表明。碳的氧化物CO2能够与H2O借助于太阳能制备HCOOH,其反应原理如下:2CO2+2H2O=2HCOOH+O2,则生成的HCOOH分子中σ键和π键的个数比是____。
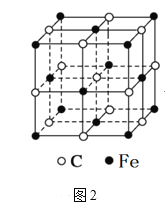
(6)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞如图2所示,则该物质的化学式为______,若晶体密度为ρg/cm3,则晶胞中最近的两个碳原子的距离为_____pm(阿伏加德罗常数的值用NA表示,写出计算式即可)。
【答案】Ⅷ 3 3d5 sp3 O>N>C>H SO42-、NH3 面心立方最密 6 4 4:1 FeC ![]()
【解析】
(1)Co是27号元素,处于周期表中第四周期第Ⅷ族,核外电子排布式为1s22s22p63s23p63d74s2;
(2)Fe的核外电子排布式为1s22s22p63s23p63d64s2,原子形成阳离子先失去高能层中电子,同一能层先失去高能级电子;分子中C原子形成3个σ键,没有孤电子对,杂化轨道数目为3;同周期主族元素随原子序数增大电负性增大,C、N、O在它们的氢化物中均表现负化合价,说明它们的电负性都比H元素的大;
(3)在第一种配合物溶液中加硝酸银溶液产生白色沉淀,说明外界为SO42-,Br-为配体,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀,说明Br-为外界,而SO42-为配体;
(4)钙离子处于顶点、面心位置,钙离子为心立方最密堆积;以顶点钙离子研究,与之最近的C22-处于棱中间,且关于顶点钙离子对称;均摊法计算晶胞中C22-数目,每个C22-含有1个σ键;
(5)HCOOH分子结构式为![]() ,单键为σ键,双键含有1个σ键、1个π键;
,单键为σ键,双键含有1个σ键、1个π键;
(6)Fe原子处于顶点、面心,碳原子处于体心、棱中心,均摊法计算Fe、C原子数目确定化学式;晶胞中最近的两个碳原子的距离为同一顶点的2条棱中心2个碳原子的距离。
(1)Co是27号元素,处于周期表中第四周期第Ⅷ族,核外电子排布式为1s22s22p63s23p63d74s2,基态钴原子中3d轨道有3个未成对电子;
(2)Fe的核外电子排布式为1s22s22p63s23p63d64s2,Fe3+的核外价电子排布式为3d5;分子中C原子形成3个σ键,没有孤电子对,杂化轨道数目为3,碳原子杂化方式为sp3;同周期主族元素随原子序数增大电负性增大,C、N、O在它们的氢化物中均表现负化合价,说明它们的电负性都比H元素的大,电负性为:O>N>C>H;
(3)在第一种配合物溶液中加硝酸银溶液产生白色沉淀,说明外界为SO42-,Br-为配体,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀,说明Br-为外界,而SO42-为配体,还有5个NH3为配体;
(4)钙离子处于顶点、面心位置,钙离子为心立方最密堆积;以顶点钙离子研究,与之最近的C22-处于棱中间,且关于顶点钙离子对称,钙离子的配位数为6;晶胞中C22-数目=1+12×![]() =4,每个C22-含有1个σ键,故一个晶胞含有的σ键平均有4个;
=4,每个C22-含有1个σ键,故一个晶胞含有的σ键平均有4个;
(5)HCOOH分子结构式为![]() ,单键为σ键,双键含有1个σ键、1个π键,分子中σ键和π键的个数比是4:1;
,单键为σ键,双键含有1个σ键、1个π键,分子中σ键和π键的个数比是4:1;
(6)Fe原子处于顶点、面心,碳原子处于体心、棱中心,晶胞中Fe原子数目=6×![]() +8×
+8×![]() =4、C原子数目=1+12×
=4、C原子数目=1+12×![]() =4,Fe、C原子数目之比为1:1,故该晶体的化学式为:FeC。在其晶胞中,最近的两个碳原子的距离为同一顶点的2条棱中心2个碳原子的距离,设晶胞中最近的两个碳原子的距离为rpm,则晶胞棱长=
=4,Fe、C原子数目之比为1:1,故该晶体的化学式为:FeC。在其晶胞中,最近的两个碳原子的距离为同一顶点的2条棱中心2个碳原子的距离,设晶胞中最近的两个碳原子的距离为rpm,则晶胞棱长=![]() rpm,晶胞质量=dg/cm3×(
rpm,晶胞质量=dg/cm3×(![]() r×10-10cm)3=4×
r×10-10cm)3=4×![]() g,解得r=
g,解得r=![]() 。
。