题目内容
14.如图装置中,b电极用金属.M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡.试回答: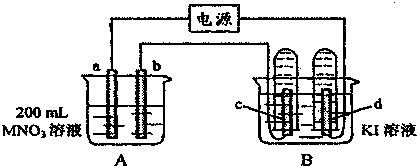
(1)a为阳极,c极的电极反应式为2I--2e-=I2.
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是:c极附近的溶液首先变成蓝色,电解进行一段时间后,罩在c极上的试管中也收集到了气体,此时c极上的电极反应为4OH--4e=2H2O+O2↑.
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上放出了0.001moL气体,若b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为108g/mol.
(4)电解停止后加蒸馏水使A烧杯中的溶液体积仍为200mL,取这种溶液加入到26.0mL0.100mol•L-1HCI溶液中,当加入31.25mL溶液时刚好沉淀完全.试计算:电解前A烧杯中MNO3溶液的物质的量浓度为0.1mol/L.
分析 根据电解原理,金属M沉积于b极,说明b是阴极,则a是阳极,c是阳极,d是阴极,
(1)根据a是阳极,溶液中的阴离子放电;
(2)在B烧杯中,c是阳极,溶液中的阴离子放电,即2I--2e-=I2;根据放电顺序先放电的I-,接着是OH-放电,
(3)根据串联电路中以及电解池中阴、阳两极得失电子数目相等求出气体的物质的量和金属的物质的量,最后根据M=$\frac{m}{n}$求出金属的摩尔质量;
(4)先根据(3)求出已放电的M+的物质的量,然后根据剩余的溶液与HCl反应求出剩余的M+,两者相加得原溶液中的M+,的物质的量,最后带入公式C=$\frac{n}{V}$,求出电解前A烧杯中MNO3溶液的物质的量浓度.
解答 解:由电解原理可得:金属M沉积于b极,说明b是阴极,则a是阳极,c是阳极,d是阴极,
(1)因a是阳极,溶液中的阴离子放电,根据离子的放电顺序,可知是I-放电:2I--2e-=I2,故答案为:阳;2I--2e-=I2;
(2)在B烧杯中,c是阳极,溶液中的阴离子放电,即2I--2e-=I2,I2遇到淀粉能使淀粉变蓝,I-放电完毕后,
接着是OH-放电:4OH--4e=2H2O+O2↑,c极上的试管中收集到的气体为氧气,
故答案为:c极附近的溶液首先变成蓝色;4OH--4e=2H2O+O2↑;
(3)d极是溶液中氢离子放电:
2H++2e-=H2↑
0.004mol $\frac{0.0448L}{22.4L/mol}$
a极上氢氧根离子放电:
4OH--4e=2H2O+O2↑
0.004mol 0.001mol
即氧气的物质的量为0.001mol
b极上氢氧根离子放电:M++e-=M
0.004mol 0.004mol
则金属的摩尔质量M=$\frac{m}{n}$=$\frac{0.432}{0.004}$=108g/mol,
故答案为:0.001;108g/mol;
(4)设稀释后溶液的浓度为X,根据反应:Cl-+M+=MCl↓
0.100 mol/L×0.025L X×0.03125L
解得X=0.08mol•L-1
所以200mL电解停止后加蒸馏水稀释的溶液中,M+ 的物质的量为0.08mol•L-1×0.2L=0.016mol,则电解前A烧杯中MNO3溶液的M+ 物质的量=0.004mol+0.16mol=0.004mol+0.016mol=0.02mol,所以MNO3溶液的物质的量浓度=$\frac{0.02mol}{0.2L}$mol/L=0.1mol/L,
故答案为:0.1mol/L.
点评 本题主要考查了电解原理的运用以及有关计算,难度不小,学生做起来有较大的难度.

| A. | 蒸发操作时,当溶液中出现较多固体应停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 如果没有试管夹,可以临时手持试管给固体或液体加热 |
| A. | 铁溶解,析出0.01molZn | |
| B. | 铁溶解,析出铜,且溶液中不含有Fe3+ | |
| C. | 铁溶解,析出0.01molCu | |
| D. | 铁溶解,溶液中金属阳离子只剩Fe2+和Zn2+ |
| A. | 24.5L氢气中所含氢原子数一定大于2NA | |
| B. | 1molCH3+电子数为9NA | |
| C. | 100g 60%CH3COOH水溶液中含有的分子数为NA | |
| D. | 常温常压下0.1mol CO和NO的混合气体含氧原子数为0.1NA |
①通过装有变色硅胶的干燥管 ②通过氢氧化钠溶液 ③通过加热的氧化铜.
| A. | ①②③③ | B. | ②①③① | C. | ②③③① | D. | ③②①③ |
| A. | 浓H2SO4沾到皮肤上,必须迅速用大量水冲洗,然后再涂稀的NaOH溶液 | |
| B. | 取用化学药品时,应特别注意观察药品包装上的安全警示标志 | |
| C. | 凡是给玻璃仪器加热,都要垫石棉网,以防仪器炸裂 | |
| D. | 闻某些化学药品的气味时可以使鼻子凑近药品 |
 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.