题目内容
4.(1)某金属氯化物MCl2 40.5g,含有0.600molCl-,则金属M的摩尔质量为64g/mol(2)请写出Na3PO4在水溶液中的电离方程式Na3PO4=3Na++PO43-
(3)1.7g NH3与标准状况下3.36L H2S含有相同数目的氢原子.
(4)某双原子分子构成的气体,其摩尔质量为M g/mol,该气体质量为 m g,阿伏加德罗常数的值为NA,则:该气体在标准状况下的密度为$\frac{M}{22.4}$ g/L
(5)相同浓度的NaCl、MgCl2、AlCl3溶液,分别与AgNO3溶液反应,当生成的AgCl沉淀的质量之比为3:2:1时,三种溶液的体积比为9:3:1.
分析 (1)含有0.600mol Cl-,则n(MCl2)=0.300mol,结合M=$\frac{m}{n}$解答;
(2)Na3PO4是强电解质,在溶液中完全电离;
(3)求出氨气的物质的量,然后根据1mol氨气中3mol氢原子,从而求出氨气中氢原子的物质的量,而1mol硫化氢中含2mol氢原子,据此求出硫化氢的物质的量和标况下的体积;
(4)标况下,气体的密度ρ=$\frac{M}{{V}_{m}}$,据此计算;
(5)由题意可知完全沉淀,则Cl-+Ag+═AgCl↓,当生成的AgCl沉淀的质量之比为3:2:1,氯离子的物质的量之比为3:2:1.
解答 解:(1)含有0.600mol Cl-,则n(MCl2)=0.300mol,由M(MCl2)=$\frac{m}{n}$=$\frac{40.5g}{0.300mol}$=135g/mol,M(M)=135g/mol-35.5g/mol×2=64g/mol,故答案为:64g/mol;
(2)Na3PO4是强电解质,在溶液中完全电离:Na3PO4=3Na++PO43-,故电离方程式为:Na3PO4=3Na++PO43-,故答案为:Na3PO4=3Na++PO43-;
(3)1.7g氨气的物质的量为0.1mol,而0.1mol氨气中0.3mol氢原子,故氨气中氢原子的物质的量为0.3mol,而1mol硫化氢中含2mol氢原子,故含有相同氢原子的硫化氢的物质的量为0.15mol,在标况下的体积V=nVm=0.15mol×22.4L/mol=3.36L,故答案为:3.36;
(4)气体摩尔质量为 M g/mol,故标况下,该气体的密度=$\frac{Mg/mol}{22.4L/mol}$=$\frac{M}{22.4}$g/L,
故答案为:$\frac{M}{22.4}$;
(5)设AgNO3溶液的浓度都是c,设体积分别为x、y、z,由题意可知完全沉淀,则Cl-+Ag+═AgCl↓,当生成的AgCl沉淀的质量之比为3:2:1,氯离子的物质的量之比为3:2:1,则cx:2cy:3cz=3:2:1,
解得x:y:z=9:3:1,
故答案为:9:3:1.
点评 本题考查有关物质的量的计算,明确质量、摩尔质量、物质的量的关系及摩尔质量与相对分子质量的关系即可解答.

| A. | 有机物和无机物都可以从动植物的有机体中获取? | |
| B. | 所有有机物在一定条件下都能相互转化? | |
| C. | 有机物和无机物在性质上的差别不是绝对的 | |
| D. | 有机物参与的反应,一般比较复杂,速率较慢,且常伴有副反应发生? |
| A. | 降低温度 | B. | 隔约空气 | ||
| C. | 既降低温度又隔绝空气 | D. | 吸走洒出的酒精 |
| A. | 在含FeCl2杂质的FeCl3溶液中通足量Cl2后,即可得到较纯净的FeCl3溶液 | |
| B. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 | |
| C. |  准确量取9.50mL水 准确量取9.50mL水 | |
| D. | 1 mol 羟基中电子数为10NA |
| A. | 打断$\frac{a}{3}$mol的N-H键同时消耗$\frac{a}{6}$mol的尿素 | |
| B. | 密闭容器中混合气体的平均摩尔质量保持不变 | |
| C. | 密闭容器中混合气体的密度保持不变 | |
| D. | 密闭容器中二氧化碳的体积分数保持不变 |
| A. | 玻璃棒下端要靠在三层滤纸处 | |
| B. | 滤纸边缘低于漏斗边缘,多余部分要剪去,并用水湿润贴紧 | |
| C. | 过滤时,为了加快过滤速度,可用玻璃棒不断搅拌 | |
| D. | 加热蒸发时,使用酒精灯的外焰加热 |
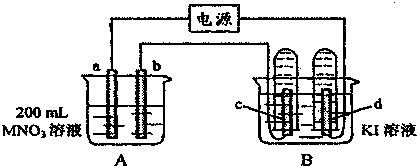
| A. | 当电池负极消耗m g气体时,电解池阴极同时有m g气体生成 | |
| B. | 电池的正极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 电解后c(Na2CO3)不变,且溶液中有晶体析出 | |
| D. | 电池中c(KOH)不变;电解池中溶液pH变大 |
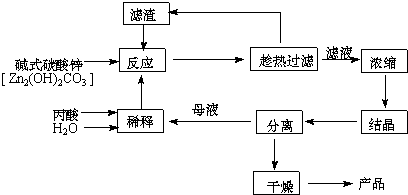
| 序号 | n(丙酸):n(碱式碳酸锌) | 反应 温度/℃ | 丙酸锌 产率/% |
| 1 | 1:0.25 | 60 | 67.2 |
| 2 | 1:0.25 | 80 | 83.5 |
| 3 | 1:0.25 | 100 | 81.4 |
| 4 | 1:0.31 | 60 | 89.2 |
| 5 | 1:0.31 | 80 | 90.1 |
| 6 | 1:0.31 | 100 | 88.8 |
(2)本题采用趁热过滤的方式,其目的是:防止醋酸锌结晶析出.
(3)实验中用水量不易过少,其原因是水的用量较少时,反应不易完全,且易造成丙酸挥发损失,不利于提高产率和产品的纯度.
(4)探究本实验中最佳工艺条件(见表):反应时间2h,用水量45g,n(丙酸):n(碱式碳酸锌)=1:0.31,反应温度80℃.
(5)某次实验时,将37.0g丙酸溶于220mL水中,按上述流程在上述优化的条件下制备,最终得产品丙酸锌49.6g,则该次实验丙酸锌的产率为:94.0%.
(6)本工艺“采用闭路循环”方式,除具有制备工艺简便、产率高外,还具有:原料利用率高,无废液、废渣排放.