题目内容
【题目】某校化学研究性学习小组设计实验验证NH3能还原CuO,并对还原产物进行探究。请回答下列问题:
Ⅰ.验证NH3能还原CuO

(1)试剂X为___________________________。
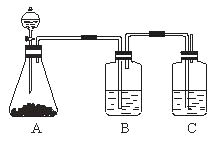
(2)请将提供的装置按合理顺序连接。g→_______________________。
(3)装置B的作用是_______________________。
(4)证明NH3能还原CuO的实验现象是_______________________。
II.探充还原产物的成分
【查阅资料】Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)=Cu+CuSO4+H2O。
【实验探究】
实验操作 | 实验现象 | 实验结论 |
取10.4g红色固体于烧杯中,加入足量稀硫酸,充分搅拌,静置 | 若无现象 | ①证明红色固体为_________。 |
若溶液变蓝 | ②证明红色固体肯定含有______,可能含有__________。 | |
取上述反应后的混合物过滤、洗涤、干燥、称重,得固体6.4g | ③经计算,红色固体的成分及其物质的量__________ |
【答案】 碱石灰 fh→a b→d e→c 吸收尾气,防止倒吸,隔绝空气,防止空气中水蒸气进入D中 A中黑色粉末变为红色,D中白色固体变为蓝色 铜 氧化亚铜 铜 铜和氧化亚铜各0.05mol
【解析】Ⅰ.(1).氯化铵和氢氧化钙反应生成氯化钙、氨气和水,试剂X需要干燥氨气且不与氨气反应,所以为碱石灰;
(2).装置C生成氨气后,首先经过E干燥,再通入A中反应,生成的气体通过D进行检测,最后以B装置收集尾气。所以安装顺序为fh→a b→d e→c ;
(3).由于氨气在水中溶解度较大,所以气体收集先将气体先通入CCL4中再溶于上层的水中,所以B装置的作用为收集尾气,防止倒吸,隔绝空气;
(4).由红色的铜生成,现象为:A中黑色粉末变为红色,同时有水生成,D中白色固体变为蓝色;
II. ①Cu,因为Cu在常温下不与稀硫酸反应;
②有CuSO4生成,溶液变蓝,则红色固体中肯定含有Cu2O,不能确定是否含有Cu;
③所得固体为Cu,物质的量为0.1mol;每摩尔Cu2O与酸反应前后质量损失为80g,反应前后质量损失为4g,则0.05mol Cu2O参与反应,则生成Cu的量为0.05mol,所以原固体中Cu2O与Cu的物质的量均为0.05mol

 同步轻松练习系列答案
同步轻松练习系列答案