题目内容
【题目】已知25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则热化学方程式正确的是
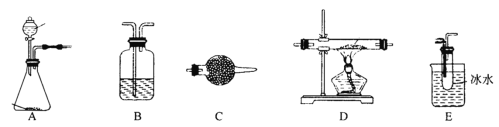
A.C(s)+![]() O2(g)=CO(g) △H=-393.5kJ/mol
O2(g)=CO(g) △H=-393.5kJ/mol
B.2H2(g)+O2(g)=2H2O(g) △H=+571.6kJ/mol
C.CH4(g)+2O2(g)=2H2O(l)+CO2(g) △H=-890.3kJ/mol
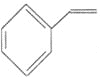
D.![]() C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(g) △H=-1400kJ/mol
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(g) △H=-1400kJ/mol
【答案】C
【解析】
A. 1molC(s)不完全燃烧放出的热量小于393.5kJ,A不正确;
B. H2(g)燃烧放热,且生成液态水,B不正确;
C. 1molCH4(g)完全燃烧生成二氧化碳和液态水,放热890.3kJ,C正确;
D.1/2mol C6H12O6(s)完全燃烧生成液态水和二氧化碳,放热才是1400kJ,D不正确;
故选C。

练习册系列答案
相关题目