题目内容
【题目】少量铁粉与![]() 的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变
的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变![]() 的产量,可以使用如下方法中的( )
的产量,可以使用如下方法中的( )
①加![]() ②加
②加![]() 固体 ③滴入几滴浓盐酸
固体 ③滴入几滴浓盐酸
④改用![]() 的硝酸 ⑤加
的硝酸 ⑤加![]() 溶液 ⑥滴加几滴硫酸铜溶液
溶液 ⑥滴加几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发) ⑧改用![]() 的盐酸
的盐酸
A. ③⑤⑥⑦B. ③⑦⑧C. ③⑥⑦⑧D. ③④⑥⑦⑧
【答案】B
【解析】
①加H2O后,稀盐酸的浓度降低,即溶液中氢离子浓度减小,反应速率减慢,故①不符合题意;
②加NaOH固体,NaOH会消耗盐酸,即溶液中氢离子浓度减小,反应速率减慢,故②不符合题意;
③滴入几滴浓盐酸后,稀盐酸的浓度增大,即溶液中氢离子浓度增大,反应速率加快,故③符合题意;
④若改用![]() 的硝酸,由于硝酸具有强氧化性,硝酸与金属铁反应不生成氢气,故④不符合题意;
的硝酸,由于硝酸具有强氧化性,硝酸与金属铁反应不生成氢气,故④不符合题意;
⑤加NaCl溶液,是溶液体积增大,即氢离子浓度减小,反应速率减慢,故⑤不符合题意;
⑥滴入几滴硫酸铜溶液,Fe与硫酸铜反应生成Cu,即形成了Fe—Cu原电池,反应速率加快,但Fe少量,导致生成的氢气减少,故⑥不符合题意;
⑦升高温度(不考虑盐酸挥发),反应速率加快,故⑦符合题意;
⑧改用![]() 的盐酸,盐酸的浓度增大,化学反应速率加快,故⑧符合题意;
的盐酸,盐酸的浓度增大,化学反应速率加快,故⑧符合题意;
故选B。

【题目】甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。
(1)以下是工业上合成甲醇的两个反应:
反应I:CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
反应II:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
①上述反应符合“原子经济"原则的是__________(填“I”或“II”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断反应I为__________热反应(填“吸"或“放”)。
③某温度下,将1mol CO和3mol H2充入1L的恒容密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为________,此时的温度为___________(从表中选择)。
(2)现以甲醇燃料电池。采用电解法来处理酸性含铬废水(主要含有Cr2O72—)时,实验室利用下图装置模拟该法:
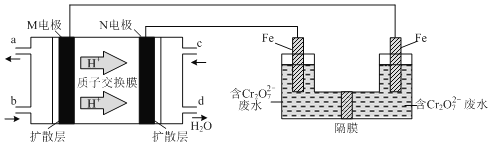
①N电极的电极反应式为_____________________。
②请完成电解池中Cr2O72—转化为Cr3+的离子反应方程式:(______) Cr2O72-+(_____) Fe2++(______)═(_____) Cr3+ +(______)Fe3++(_____) H2O
(3)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10—5mol-L-1时,Cr3+沉淀完全,此时溶液的pH=_____________(已知,Ksp[Cr(OH)3]=1.0×10-32)