题目内容
【题目】(1)在25℃、1.01×105Pa时,16g S粉在足量的氧气中充分燃烧生成二氧化硫气体,放出148.5kJ的热量,则S的燃烧热的热化学方程式为:___。
(2)1L1mol/L稀盐酸跟1L1mol/LNaOH溶液起中和反应放出57.3kJ热量,其热化学方程式为:___。
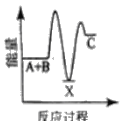
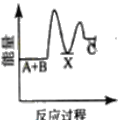
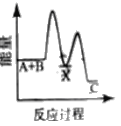
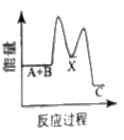
(3)已知如图所示的可逆反应:

①A(g)+B(g)![]() 2C(g) +D(g);ΔH=QkJ/mol则Q___0(填“>”、“<”或“=”)
2C(g) +D(g);ΔH=QkJ/mol则Q___0(填“>”、“<”或“=”)
②反应体系中加入催化剂,反应速率增大,则E1的变化是:E1___,ΔH的变化是:ΔH___(填“增大”“减小”“不变”)。
(4)发射卫星用N2H4作燃料,NO2作氧化剂,两者反应生成N2和水蒸气,
已知:N2(g)+2O2(g)=2NO2(g) △H1=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H2=-534kJ/mol
则1mol气体肼和NO2完全反应时的反应热△H=___kJ/mol。
(5)已知反应A放出热量Q1kJ,焓变为△H1,反应B放出热量Q2kJ,焓变为△H2,若Q1>Q2,则△H1___△H2
(6)1molC与1molH2O(g)反应生成1molCO(g)和1molH2(g),需吸收131.5kJ的热量,该反应的反应热为△H=___kJ/mol;
(7)反应A+3B=2C+2D在四种不同情况下的反应速率分别为:
①v(A)=0.15mol/(Ls) ②v(B)=0.6mol/(Ls)
③v(C)=0.4mol/(Ls) ④v(D)=0.45mol(Ls)
则该反应进行最快的为___(填序号)
【答案】S(s)+O2(g)=SO2(g) △H=﹣297kJ/mol HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) △H=﹣57.3kJ/mol < 减小 不变 ﹣567.85kJ/mol < +131.5 ④
【解析】
(1)根据n=![]() 计算出硫的物质的量,可计算出1molS燃烧放出的热量,进而书写热化学方程式;
计算出硫的物质的量,可计算出1molS燃烧放出的热量,进而书写热化学方程式;
(2)依据酸碱中和反应的特征和热化学方程式的书写原则得到;
(3)①图象分析可知反应物A、B的能量高于生成物C、D,说明反应为放热反应;
②催化剂降低反应的活化能加快反应速率,不改变化学平衡,反应焓变不变;
(4)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(5)反应放热,焓变为负值,则放热越多,焓变越小;
(6)反应吸热,焓变为正值;
(7)根据反应方程式,利用化学反应速率之比等于化学计量数之比来转化为同种物质的反应速率,然后比较大小。
(1)n(S)=![]() =0.5mol,则1molS完全燃烧放出的热量为148.5kJ×2=297kJ,则热化学方程式为S(s)+O2(g)=SO2(g) △H=﹣297kJ/mol;
=0.5mol,则1molS完全燃烧放出的热量为148.5kJ×2=297kJ,则热化学方程式为S(s)+O2(g)=SO2(g) △H=﹣297kJ/mol;
(2)1L 1mol/L稀盐酸跟1L 1mol/L NaOH溶液反应生成1mol水放热57.3KJ,该反应的热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) △H=﹣57.3kJ/mol;
(3) ①A(g)+B(g)![]() 2C(g) +D(g);△H=Q kJ/mol,图中反应物能量高于生成物能量,能量守恒可知反应为放热反应,反应焓变小于0,
2C(g) +D(g);△H=Q kJ/mol,图中反应物能量高于生成物能量,能量守恒可知反应为放热反应,反应焓变小于0,
故答案为:<;
②反应体系中加入催化剂,降低反应的活化能,E1减小,反应速率增大,但催化剂不改变平衡,不改变反应的焓变,△H不变,
故答案为:减小;不变;
(4) N2(g)+2O2(g)=2NO2(g) △H1=+67.7kJ/mol ①
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H2=-534kJ/mol ②
结合盖斯定律②×2①得到肼与NO2反应的热化学方程式:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H=2![]() (534 kJ/mol)(+67.7 kJ/mol)=1135.7 kJ/mol,1mol气体肼和NO2完全反应时放出的热量为567.85kJ对应的热化学方程式为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H=567.85 kJ/mol,故答案为:﹣567.85kJ/mol;
(534 kJ/mol)(+67.7 kJ/mol)=1135.7 kJ/mol,1mol气体肼和NO2完全反应时放出的热量为567.85kJ对应的热化学方程式为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H=567.85 kJ/mol,故答案为:﹣567.85kJ/mol;
(5)反应放热,焓变为负值,则放热越多,焓变越小,所以A放出热量Q1kJ,焓变为△H1,反应B放出热量Q2kJ,焓变为△H2,若Q1>Q2,则△H1<△H2;故答案为:<;
(6)反应吸收,焓变为正值,则吸收131.5kJ的热量,该反应的反应热为△H = +131.5 kJ/mol,故答案为:+131.5;
(3)以v(A)=0.15mol/(Ls)为标准进行判断,
①v(A)=0.15mol/(Ls);
②v(B)=0.6mol/(Ls),反应速率之比等于化学计量数之比,所以v(A)=![]() v(B)=0.2 mol/(Ls)
v(B)=0.2 mol/(Ls)
③v(C)=0.4mol/(Ls),反应速率之比等于化学计量数之比,所以v(A)=![]() v(C)=0.2 mol/(Ls)
v(C)=0.2 mol/(Ls)
④v(D)=0.45mol(Ls) ,反应速率之比等于化学计量数之比,所以v(A)=![]() v(D)=0.225 mol/(Ls),所以反应速率为④>②=③>①,该反应进行最快的为④,故答案为:④;
v(D)=0.225 mol/(Ls),所以反应速率为④>②=③>①,该反应进行最快的为④,故答案为:④;

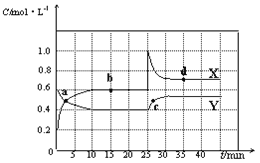
【题目】Ⅰ为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3 molH2。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0kJ·mol-1。T1温度下,测得CO2和CH3OH(g)的浓度随时间变化如图。
CH3OH(g)+H2O(g) ΔH=-49.0kJ·mol-1。T1温度下,测得CO2和CH3OH(g)的浓度随时间变化如图。

请回答:
(1)从反应开始到平衡,氢气的反应速率v(H2)=____。
(2)能够说明该反应已达到平衡的是____(填字母序号,下同)。
A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO、H2和CH3OH的浓度保持不变
D.一定条件下,单位时间内消耗3 molH2的同时生成1molCH3OH
(3)下列措施中能使平衡混合物中n(CH3OH)/n(CO2)增大的是_____。
A.加入催化剂
B.充入He(g),使压强增大
C.将H2O(g)从体系中分离
D.降低温度
(4)求此温度(T1)下该反应的平衡常数K1=____(计算结果保留三位有效数字)。
Ⅱ.下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积 | 1×10-14 | a | 1×10-12 |
试回答下列问题:
(1)若25<t1<t2,则a___(填“>”“<”或“=”)1×10-14,作出此判断的理由是_____。
(2)在t1时,测得纯水中的c(H+)=2.4×10-7mol·L-1,则c(OH-)为___。该温度下,测得某H2SO4溶液中c(SO42-)=5×10-6mol·L-1,该溶液中c(H+)=___mol·L-1,c(OH-)=___mol·L-1。
【题目】甲醛(HCHO)在化工、医药、农药等方面有广泛的应用。利用甲醛一定条件下直接脱氢可制甲醛,反应方程式:CH3OH(g)![]() HCHO(g)+H2(g) △H1
HCHO(g)+H2(g) △H1
实验测得随温度升高,平衡常数如下表所示。
温度(K) | 500 | 700 | T1 | T2 | T3 |
平衡常数 | 7.13×10-4 | 3.30×10-1 | 2.00 | 9.00 | 10.00 |
(1)甲醛分子中所有原了都达到稳定结构,甲醛的电子式为_____________。
(2) 若在恒温恒压容器中进行上述反应,可判断反应到达平衡状态的是_______________。
A.混合气体的密度不变
B.CH3OH、HCHO的物质的量浓度之比为1:1
C.H2的体积分数不再改变
D.单位时间内甲醛的生成量与氢气的消耗量相等
(3)T1时,CH3OH、HCHO、H2 起始浓度(mol·L-1)分别为1.0、0.50 、1.0,反应达到平衡时,HCHO 的体积分数___________20% (填“>”、“ =”、“ <”)。
(4)工业上采用膜分离器(对氢气具有很高的选择性和透过率)催化脱氢,装置如下图。为探究转化率变化,分别在普通反应器和膜反应器中,改变原料气压强,控制相同温度,经过相同反应时间,测定甲醇转化率,实验结果如下图。
①A点:v正______v逆(填“>”、“ =”、“ <”),理由是____________;
②B点比A点转化率高的原因是_______________。

(5)体系中加入一定量氧气有利于甲醛的生成。反应体系中存在下列反应:
CH3OH(g)+1/2O2(g)![]() HCHO(g)+H2O(g) △H2
HCHO(g)+H2O(g) △H2
H2(g)+12O2(g)![]() H2O(g) △H3
H2O(g) △H3
则△H2、△H3的大小关系是△H2________△H3(填“>”、“ =”、“ <”)。