题目内容
【题目】下列措施或事实不能用勒夏特列原理解释的是( )
A.滴加酚酞的氨水中加入氯化铵固体后红色变浅
B.棕红色的NO2加压后颜色先变深后变浅(已知:2NO2(g)![]() N2O4(g))
N2O4(g))
C.煅烧粉碎的硫铁矿利于SO2的生成
D.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率
【答案】C
【解析】
A.因为氨水中存在一水合氨的电离平衡,向滴加酚酞的氨水中加入氯化铵,铵根离子浓度增大,抑制一水合氨的电离,氢氧根离子浓度降低,溶液颜色变浅,能用勒夏特列原理解释,A项错误;
B.加压二氧化氮的浓度增大,平衡向生成四氧化二氮的方向移动,故加压后颜色先变深后变浅,但仍比原来的颜色深,可以勒夏特列原理解释,B项错误;
C.煅烧粉碎的硫铁矿增大反应接触面积,加快反应速率,利于SO2的生成,不存在平衡移动,所以不能用勒夏特列原理解释,C项正确;
D.存在2SO2+O2![]() 2SO3,过量的空气使平衡正向移动,二氧化硫的转化率增大,能用勒夏特列原理解释,D项错误;
2SO3,过量的空气使平衡正向移动,二氧化硫的转化率增大,能用勒夏特列原理解释,D项错误;
答案选C。

 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案【题目】氮的化合物既是一种资源,也会给环境造成危害。
I.氨气是一种重要的化工原料。
(1)NH3与CO2在120°C,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)![]() (NH2)2CO(s)+H2O(g),ΔH= -x KJ/mol (x>0),其他相关数据如表:
(NH2)2CO(s)+H2O(g),ΔH= -x KJ/mol (x>0),其他相关数据如表:
物质 | NH3(g) | CO2(g) | CO(NH2)2(s) | H2O(g) |
1mol分子中的化学键断裂时需要吸收的能量/KJ | a | b | z | d |
则表中z(用x a b d表示)的大小为________。
(2)120℃时,在2L密闭反应容器中充入3mol CO2与NH3的混合气体,混合气体中NH3的体积分数随反应时间变化关系如图所示,该反应到达平衡时CO2的平均反应速率为_____, 此温度时的平衡常数为_____。

下列能使正反应的化学反应速率加快的措施有___________.
① 及时分离出尿素 ② 升高温度 ③ 向密闭定容容器中再充入CO2 ④ 降低温度
Ⅱ.氮的氧化物会污染环境。目前,硝酸厂尾气治理可采用NH3与于NO在催化剂存在的条件下作用,将污染物转化为无污染的物质。某研究小组拟验证NO能被氨气还原并计算其转化率(已知浓硫酸在常温下不氧化NO气体)。

(l)写出装置⑤中反应的化学方程式_________。
(2)装置①和装置②如下图,仪器A的名称为_____,其中盛放的药品名称为_______。

装置②中,先在试管中加入2-3 粒石灰石,注入适量稀硝酸,反应一段时间后,再塞上带有细铜丝的胶塞进行后续反应,加入石灰石的作用是________。
(3)装置⑥中,小段玻璃管的作用是______;装置⑦的作用是除去NO, NO与FeSO4溶液反应形成棕色[Fe(NO)]SO4溶液,同时装置⑦还用来检验氨气是否除尽,若氨气未除尽,可观察到的实验现象是_________。
【题目】无机化合物可根据其组成和性质进行分类。
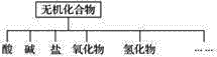
(1)上图所示的物质分类方法名称是____________。
(2)以钠、钾、氢、氧、碳、硫、氮中任两种或三种元素组成合适的物质,分别填在下表中的横线上:
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①HCl ②____ | ③____ ④Ba(OH)2 | ⑤Na2CO3 ⑥____ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
(3)写出⑦转化为⑤的化学方程式__________。
(4)写出实验室由⑩制备氧气的化学方程式______。
(5)实验室制备⑦常用________和________反应,检验该气体的方法是________。