题目内容
【题目】Ⅰ为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3 molH2。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0kJ·mol-1。T1温度下,测得CO2和CH3OH(g)的浓度随时间变化如图。
CH3OH(g)+H2O(g) ΔH=-49.0kJ·mol-1。T1温度下,测得CO2和CH3OH(g)的浓度随时间变化如图。

请回答:
(1)从反应开始到平衡,氢气的反应速率v(H2)=____。
(2)能够说明该反应已达到平衡的是____(填字母序号,下同)。
A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO、H2和CH3OH的浓度保持不变
D.一定条件下,单位时间内消耗3 molH2的同时生成1molCH3OH
(3)下列措施中能使平衡混合物中n(CH3OH)/n(CO2)增大的是_____。
A.加入催化剂
B.充入He(g),使压强增大
C.将H2O(g)从体系中分离
D.降低温度
(4)求此温度(T1)下该反应的平衡常数K1=____(计算结果保留三位有效数字)。
Ⅱ.下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积 | 1×10-14 | a | 1×10-12 |
试回答下列问题:
(1)若25<t1<t2,则a___(填“>”“<”或“=”)1×10-14,作出此判断的理由是_____。
(2)在t1时,测得纯水中的c(H+)=2.4×10-7mol·L-1,则c(OH-)为___。该温度下,测得某H2SO4溶液中c(SO42-)=5×10-6mol·L-1,该溶液中c(H+)=___mol·L-1,c(OH-)=___mol·L-1。
【答案】0.225mol·L-1min-1 AC CD 5.33 > 温度升高,水的电离程度增大,离子积增大 2.4×10-7mol·L-1 1×10-5 5.76×10-9
【解析】
Ⅰ(1)由图可知,二氧化碳的浓度变化量为0.75mol/L,结合反应可知消耗H2,结合化学反应速率的定义求解;
(2)结合平衡的特征“等、定”及衍生的物理量判断;
(3)若能使n(CH3OH)/n(CO2)增大,则需使平衡向正向移动;
(4)K为生成物浓度幂之积与反应物浓度幂之积的比,结合平衡浓度计算K;
Ⅱ. (1)水的电离是吸热反应,升高温度促进水电离,导致水的离子积常数增大;
(2)依据纯水存在电离平衡,电离出的氢离子浓度和氢氧根离子浓度相同来计算回答;
Ⅰ(1)由图可知,二氧化碳的浓度变化量为0.75mol/L,消耗c(H2)=0.75 mol·L-1×3=2.25 mol·L-1,则v(H2)=![]() =0.225mol·L-1min-1,故答案为:0.225mol·L-1min-1;
=0.225mol·L-1min-1,故答案为:0.225mol·L-1min-1;
(2)A. 容器内压强不再变化,可知物质的量不变,为平衡状态,A项正确;
B. 质量、体积始终不变,则密度始终不变,不能判断平衡状态,B项错误;
C. 浓度保持不变,为平衡状态,C项正确;
D. 单位时间内消耗3molH2的同时生成1molCH3OH,只体现正反应速率,不能确定正逆反应速率关系,不能判断平衡状态,D项错误;
故答案为:AC;
(3)A. 加入催化剂,平衡不移动, n(CH3OH)/n(CO2)不变,A项错误;
B. 充入He(g),使体系压强增大,但参加反应各物质的浓度保持不变,则平衡不移动, n(CH3OH)/n(CO2)不变,B项错误;
C. 将H2O(g)从体系中分离,平衡向正向移动,能使n(CH3OH)/n(CO2)增大,C项正确;
D. 降低温度,平衡向正向移动, 能使n(CH3OH)/n(CO2)增大,D项正确;
故答案为:CD;
(4)CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的化学平衡常数K=
CH3OH(g)+H2O(g)的化学平衡常数K= ,
,
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
开始(mol/L) 1300
转化(mol/L) 0.752.250.750.75
平衡(mol/L) 0.250.750.750.75
K=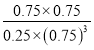 =
=![]() ,
,
故答案为:5.33;
Ⅱ. (1)水的电离为吸热反应,升高温度,平衡向着正反应方向移动,导致水的离子积常数增大,根据表格知,温度大小顺序是,25<t1<t2,则a>1×1014,
故答案为:>;温度升高,水的电离程度增大,离子积增大;
(2) 在t1时,测得纯水中的c(H+)=2.4×10-7mol·L-1,则此时水的c(OH)= c(H+)=2.4×107 mol/L;某H2SO4溶液中c(SO42-)=5×10-6mol·L-1,则氢离子浓度为1×10-5mol/L,该溶液中c(OH)=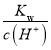 =
=![]() =5.76×10-9molL1,
=5.76×10-9molL1,
故答案为:2.4×107 mol/L; 1×10-5;5.76×10-9。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】氮的化合物既是一种资源,也会给环境造成危害。
I.氨气是一种重要的化工原料。
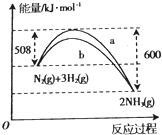
(1)NH3与CO2在120°C,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)![]() (NH2)2CO(s)+H2O(g),ΔH= -x KJ/mol (x>0),其他相关数据如表:
(NH2)2CO(s)+H2O(g),ΔH= -x KJ/mol (x>0),其他相关数据如表:
物质 | NH3(g) | CO2(g) | CO(NH2)2(s) | H2O(g) |
1mol分子中的化学键断裂时需要吸收的能量/KJ | a | b | z | d |
则表中z(用x a b d表示)的大小为________。
(2)120℃时,在2L密闭反应容器中充入3mol CO2与NH3的混合气体,混合气体中NH3的体积分数随反应时间变化关系如图所示,该反应到达平衡时CO2的平均反应速率为_____, 此温度时的平衡常数为_____。

下列能使正反应的化学反应速率加快的措施有___________.
① 及时分离出尿素 ② 升高温度 ③ 向密闭定容容器中再充入CO2 ④ 降低温度
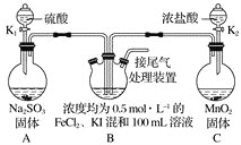
Ⅱ.氮的氧化物会污染环境。目前,硝酸厂尾气治理可采用NH3与于NO在催化剂存在的条件下作用,将污染物转化为无污染的物质。某研究小组拟验证NO能被氨气还原并计算其转化率(已知浓硫酸在常温下不氧化NO气体)。

(l)写出装置⑤中反应的化学方程式_________。
(2)装置①和装置②如下图,仪器A的名称为_____,其中盛放的药品名称为_______。

装置②中,先在试管中加入2-3 粒石灰石,注入适量稀硝酸,反应一段时间后,再塞上带有细铜丝的胶塞进行后续反应,加入石灰石的作用是________。
(3)装置⑥中,小段玻璃管的作用是______;装置⑦的作用是除去NO, NO与FeSO4溶液反应形成棕色[Fe(NO)]SO4溶液,同时装置⑦还用来检验氨气是否除尽,若氨气未除尽,可观察到的实验现象是_________。