题目内容
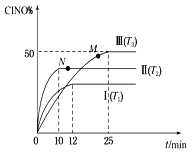
【题目】已知NO2和N2O4可以相互转化:2NO2(g)![]() N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭容器中,反应物浓度随时间变化关系如图所示。
N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭容器中,反应物浓度随时间变化关系如图所示。
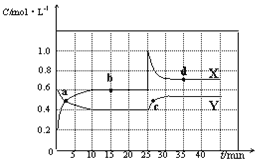
(1)图中共有两条曲线X和Y,其中表示NO2浓度随时间变化的曲线是___;a、b、c、d四个点中,表示化学反应处于平衡状态的点是___。
(2)前10min内用NO2表示的化学反应速率v(NO2)=___mol·L-1·min-1。
(3)①据图分析,在25min时采取的措施是___(填序号)。
A.加入催化剂 B.缩小容器体积
C.加入一定量的NO2 D.加入一定量的N2O4
②若在35 min时,保持温度不变,快速缩小容器的体积至1L,气体的颜色变化过程是___。
【答案】X b、d 0.04 C 先变深后变浅
【解析】
由图可知0-10min平衡状态时,X表示的生成物的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线,结合外因对化学反应速率与化学平衡的影响效果分析作答。
根据上述分析可知,
(1)表示NO2浓度随时间变化的曲线是X,反应达到平衡状态时,各物质的浓度保持不变,则a、b、c、d四个点中,表示化学反应处于平衡状态的点是b、d,故答案为:X;b、d;
(2)由图象可知,10 min内NO2的浓度变化量为(0.60.2) mol·L-1=0.4 mol·L-1,故v(NO2)=![]() =0.04 mol·L-1·min-1,故答案为:0.04;
=0.04 mol·L-1·min-1,故答案为:0.04;
(3)①25min时,X的浓度增大,Y的浓度不变,只能是增大X的浓度,所以曲线发生变化的原因是增加NO2浓度,C项正确,故答案为:C;
②若在35 min时,保持温度不变,快速缩小容器的体积至1L,相当于增大压强,则瞬间二氧化氮的浓度增大为原来的2倍,过程中,平衡向正反应方向移动,最后二氧化氮的浓度大于1倍小于2倍,现象为:先变深后变浅。