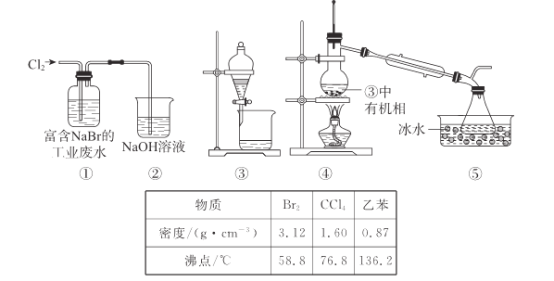
题目内容
【题目】铜是重要的贵重金属,其化合物在催化剂研究和光电材料等方面应用广泛。回答下列问题:
(1)在铜的配合物中,H2O、NH3、CO等常用作配体。
①基态Cu2+的价电子轨道表示式为_________。
②H、C、N、O元素中,元素的第一电离能最高的为_____,元素电负性由大到小的顺序为________。
③水溶液中有H3O+、H5O2+、H9O4+等微粒的形式。H3O+中O的杂化轨道类型为_____,其H-O-H键角_______(填“>”或“<”)H2O中H-O-H的键角。H5O2+内部存在氢键,H5O2+的结构式可表示为__________。
④Cu2Cl2·2CO·2H2O是一种配合物,其结构如图所示:![]() ,其中每个Cu原子能与其他原子形成_________个配位键。
,其中每个Cu原子能与其他原子形成_________个配位键。
(2)CuCl结构属于立方晶系,其晶胞如图所示:

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。则A原子分数坐标为_________。
②晶胞中距离每个Cu+最近的Cl-的个数为_______,若晶胞的棱长为a pm,晶体的密度为ρ g·cm-3,计算阿伏加德罗常数NA=________(列式表示)。
【答案】![]() N O>N>C>H sp3 >
N O>N>C>H sp3 > ![]() 或
或![]() 3
3 ![]() 4
4 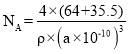
【解析】
(1)①基态Cu原子的核外电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1;
②同周期第ⅡA和第ⅤA的元素第一电离能大于相邻族元素,同周期从左到右电负性增强;
③先确定VSEPR模型,然后在确定中心原子的杂化轨道类型;一般来说,相互之间排斥力的大小为:孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力;氧原子可与氢原子形成氢键;
④形成配位键时,亚铜离子提供空轨道,氯原子提供共用电子对;
(2)①根据A原子在晶胞中的位置关系分析判断;
②根据图知,该晶胞中距离每个Cu+最近的Cl-的个数为4,根据晶胞密度公式ρ=![]() 进行计算。
进行计算。
(1)①基态Cu原子的核外电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,基态Cu2+的核外电子排布式为1s22s22p63s23p63d9或[Ar]3d9,其价电子轨道表示式为![]() ;
;
②同周期第ⅡA和第ⅤA的元素第一电离能大于相邻族元素,所以第一电离能N>O,H、C、N、O元素中,元素的第一电离能最高的为N;同周期从左到右电负性增强,所以电负性O>N>C>H;
③H3O+价层电子对模型为四面体,氧原子采取sp3杂化;H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中HOH键角比H2O中HOH键角大;H5O2+内部存在氢键,H5O2+的结构式可表示为![]() 或
或![]() ;
;
④根据氯原子最外层电子数为7可知,氯原子可形成一对共用电子对,即氯原子形成的两条共价键中只有一条为配位键,而X可形成三条配位键, 如图所示: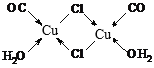 ;
;
(2)①C点的原子与上平面面心的小球相连,且与顶点组成等边三角形,故在x、y平面的投影为(![]() ,
,![]() ),同理可得在z轴的投影为
),同理可得在z轴的投影为![]() ,则A原子分数坐标为(
,则A原子分数坐标为(![]() ,
,![]() ,
,![]() );
);
②根据图知,该晶胞中距离每个Cu+最近的Cl的个数为4,氯离子的配位数是4;该晶胞中,氯原子位于晶胞的顶点和面心,氯原子的个数=8×![]() +6×
+6×![]() =4,铜原子位于晶胞内部,铜原子个数=4若晶胞的棱长为a pm,则晶胞的体积V=a3 pm3= (a×10-10)3cm3,晶体的密度为ρ g·cm-3,ρ=
=4,铜原子位于晶胞内部,铜原子个数=4若晶胞的棱长为a pm,则晶胞的体积V=a3 pm3= (a×10-10)3cm3,晶体的密度为ρ g·cm-3,ρ=![]() ,阿伏加德罗常数
,阿伏加德罗常数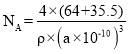 。
。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案