题目内容
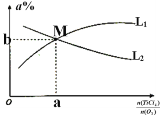
【题目】用单质铁去除酸性水体中NO3-的原理如图所示,下列说法错误的是
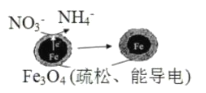
A.能量转化形式主要为化学能转化为电能
B.该原理的总反应可表示为NO3-+3Fe+2H++H2O=NH4++Fe3O4
C.电极材料分别为Fe和Fe3O4
D.负极反应为NO3-+8e-+10H+=NH4++3H2O
【答案】D
【解析】
A.根据图像可知,反应中存在电子的转移,则能量转化形式主要为化学能转化为电能,说法正确;
B.根据图像可知,该原理的总反应可表示为NO3-+3Fe+2H++H2O=NH4++Fe3O4,说法正确;
C.根据图像可知,疏松的Fe3O4能导电,则电极材料分别为Fe和Fe3O4,说法正确;
D.负极失电子,反应为3Fe-8e-+4H2O=Fe3O4+8H+,说法错误;
答案为D。

 阅读快车系列答案
阅读快车系列答案【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:

相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMn![]() 时,z=___________。
时,z=___________。