题目内容
【题目】TiO2和TiCl4均为重要的化工原料,已知:
Ⅰ.TiCl4(g) + O2(g)![]() TiO2(s) + 2Cl2(g) ΔH =-175.4 kJ/mol
TiO2(s) + 2Cl2(g) ΔH =-175.4 kJ/mol
Ⅱ.2C(s) + O2(g) ![]() 2CO(g) ΔH =-220.9 kJ/mol
2CO(g) ΔH =-220.9 kJ/mol
请回答下列问题:
(1)TiCl4(g)+2CO(g)![]() TiO2(s)+2C(s)+2Cl2(g) 的ΔH =____________ kJ/mol
TiO2(s)+2C(s)+2Cl2(g) 的ΔH =____________ kJ/mol
(2)toC时,向10L恒容密闭容器中充入1mol TiCl4和2molO2,发生反应I,4min达到平衡时测得TiO2的物质的量为0.2mol。
① 反应4min末的平均速率v(Cl2)=_____,该温度下K =____(用分数表示),O2的平衡转化率=_______.
② 下列措施,既能加快正反应速率,又能增大O2的平衡转化率的是________
A.缩小容器的体积 B.加入催化剂 C.分离出部分TiO2
D.增加O2的浓度 E.减低温度 F.以上方法均不可以
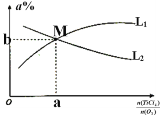
③toC时,向10L恒容密闭容器中充入3molTiCl4和一定量的O2,发生反应I,两种气体的平衡转化率(a%)与起始的物质的量之比(TiCl4/O2)的关系如图所示:能表示O2的平衡转化率的曲线为_________ (填“L1”或“L2”)M点的坐标为______________(用整数或分数表示)
(3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中:c(NH4+)_____c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×107mol·L1,K2=4×1011mol·L1)
NH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×107mol·L1,K2=4×1011mol·L1)
【答案】+45.5kJ/mol 0.01 mol/(Lmin) ![]() 10% F L1 (1,
10% F L1 (1,![]() ) > 1.25×103
) > 1.25×103
【解析】
(1)已知Ⅰ.TiCl4(g)+O2(g)TiO2(s)+2Cl2(g)△H=-175.4kJ/mol
Ⅱ.2C(s)+O2(g)2CO(g)△H=-220.9kJ/mol
根据盖斯定律Ⅰ-Ⅱ得TiCl4(g)+2CO(g)TiO2(s)+2C(s)+2Cl2(g)△H=(-175.4+220.9)kJ/mol=+45.5kJ/mol;
(2)初始投料为1molTiCl4和2mol O2,容器体积为10L,列三段式有:
 ;
;
①反应0~4min末的平均速率v(Cl2)=![]() =0.01 mol/(Lmin);根据平衡常数的定义可知K=
=0.01 mol/(Lmin);根据平衡常数的定义可知K=![]() ;O2的平衡转化率=
;O2的平衡转化率=![]() =10%;
=10%;
②A.缩小容器的体积,相当于增大压强,该反应是气体体积不变的反应,平衡不移动,不能增大氧气的转化率,故A错误;
B.加入催化剂,只改变反应速率,不改变平衡状态,不能增大氧气的转化率,故B错误;
C.分离出部分TiO2,使平衡正向移动,但不能加快正反应速率,故C错误;
D.增大氧气浓度,反应速率加快,平衡正向移动,但起始物质的量增大,转化率减小,故D错误;
E.温度降低,反应速率减慢,故E错误;
F.由上述分析可知,方法均不合理,故F正确,所以答案为F;
③TiCl4的量为定值,则随着氧气的物质的量的增加,平衡逐渐正向移动,TiCl4的转化率逐渐增大,即![]() 越小TiCl4的转化率越大,同理可知
越小TiCl4的转化率越大,同理可知![]() 越大,氧气的转化率越大,所以L1代表O2的平衡转化率曲线;
越大,氧气的转化率越大,所以L1代表O2的平衡转化率曲线;
M点二者的转化率相同,则这两物质的起始物质的量相等,列三段式有:
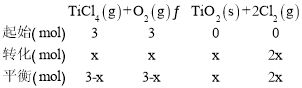
根据第(2)小题可知该温度下平衡常数为![]() ,该反应前后气体的计量数之和相等,所以可以用物质的量来代替浓度计算平衡常数,所以有
,该反应前后气体的计量数之和相等,所以可以用物质的量来代替浓度计算平衡常数,所以有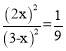 ,解得x=
,解得x=![]() ,转化率为
,转化率为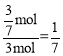 ,所以坐标为(1,
,所以坐标为(1,![]() );
);
(3)已知常温下NH3H2O的电离平衡常数Kb=2×10-5molL-1,H2CO3的电离平衡常数Ka1=4×10-7moL-1,Ka2=4×10-11molL-1,NH3H2O的电离程度大于H2CO3的一级电离程度,则HCO3-的水解程度大于NH4+的水解程度,故在NH4HCO3溶液中,c(NH4+)>c(HCO3-);
对于反应NH4++HCO3-+H2ONH3H2O+H2CO3的平衡常数K=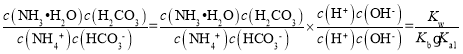 =1.25×10-3。
=1.25×10-3。

 特高级教师点拨系列答案
特高级教师点拨系列答案