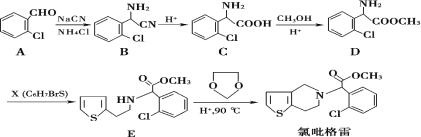
题目内容
【题目】![]() 广泛用作有机反应催化剂。十堰市采用镁屑与液溴为原料制备无水
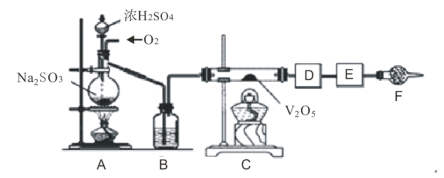
广泛用作有机反应催化剂。十堰市采用镁屑与液溴为原料制备无水![]() ,装置如图1,主要步骤如下:
,装置如图1,主要步骤如下:
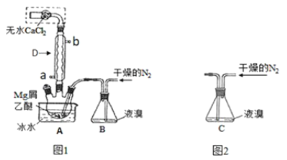
步骤1:三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴。
步骤2:缓慢通入干燥的氮气,直至溴完全导入三口瓶中。
步骤3:反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4:常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水![]() 产品。
产品。
已知:①![]() 和
和![]() 剧烈反应,放出大量的热;
剧烈反应,放出大量的热;![]() 具有强吸水性;
具有强吸水性;
②乙醚![]() 极易挥发;
极易挥发;
③![]()
![]()
请回答下列问题:
(1)仪器D的作用是__________;
(2)无水![]() 的作用是__________。
的作用是__________。
(3)步骤2通入干燥的![]() 的目的是______;实验中不能用干燥空气代替干燥
的目的是______;实验中不能用干燥空气代替干燥![]() ,原因是________。
,原因是________。
(4)若将装置B改为装置C(图2),可能会导致的后果是______
(5)步骤4用苯溶解粗品的目的是_________。
(6)从平衡移动的角度解释得到三乙醚合溴化镁后,加热有利于得到无水![]() 产品的原因:_________
产品的原因:_________
【答案】冷凝回流 防止空气中的水蒸气进入A 装置 将溴蒸汽吹出 镁屑会与空气中的氧气反应,生成的![]() 阻碍反应的继续进行 会将液溴挤压入A中,剧烈反应,放出大量热,存在安全隐患 除去溴、乙醚等杂质 该反应为放热反应,且加热促使乙醚挥发,加热后平衡逆向移动
阻碍反应的继续进行 会将液溴挤压入A中,剧烈反应,放出大量热,存在安全隐患 除去溴、乙醚等杂质 该反应为放热反应,且加热促使乙醚挥发,加热后平衡逆向移动
【解析】
(1)乙醚和溴都易挥发,据此分析作用;
(2)MgBr2具有强吸水性,据此分析;
(3)根据溴单质具有挥发性分析;空气中的氧气与Mg反应;
(4)将装置B改为装置C,会将液溴挤压入三口瓶中,而Mg和Br2反应剧烈放热;
(5)粗品含有溴和乙醚等杂质,需要除去;
(6)已知:MgBr2+3C2H5OC2H5MgBr23C2H5OC2H5△H<0,加热有利于吸热方向,同时乙醚会挥发,据此分析。
(1)仪器D为球形冷凝管,作用是使挥发出的乙醚和溴蒸气冷却并回流至反应装置;
(2)![]() 具有强吸水性,无水
具有强吸水性,无水![]() 的作用是防止空气中的水蒸气进入A 装置;
的作用是防止空气中的水蒸气进入A 装置;
(3)因为液溴极易挥发,故干燥的N2可将液溴吹出;镁屑会与空气中的氧气反应,生成的MgO阻碍反应的继续进行,故实验中不能用干燥空气代替干燥N2;
(4)已知:Mg和Br2反应剧烈放热,将装置B改为装置C,会将液溴挤压入三口瓶中,反应加剧大量放热存在安全隐患;
(5)步骤4用苯溶解粗品的目的是除去溴、乙醚等杂质;
(6)已知MgBr2+3C2H5OC2H5MgBr23C2H5OC2H5 △H<0,加热促使乙醚挥发,且逆反应是吸热反应,加热后平衡朝有利于三乙醚合溴化镁分解的方向移动。

【题目】下表是周期表的一部分,根据A~I在周期表中的位置,回答以下问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | J | F | H | I |
(1)表中元素,化学性质最不活泼的是__(用元素符号表示,本小题下同);被选做相对原子质量标准的核素是__(填核素符号);除稀有气体外,原子半径最大的是__,可用于制半导体材料的元素是__,形成化合物中种类最多的元素是__。
(2)最高价氧化物的水化物酸性最强的是__(填化学式),A分别与D、E、F、G、H形成的化合物中,最稳定的是__(填化学式)。
(3)B和H形成化合物的电子式为_。
(4)元素E和元素H的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式__。
(5)B、C两元素的最高价氧化物对应水化物之间反应的离子方程式是__。