题目内容
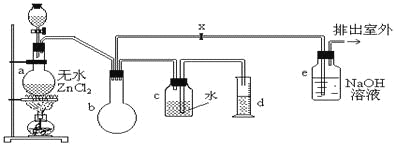
【题目】用下列实验装置进行相应实验,能达到实验目的的是
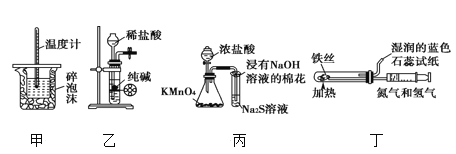
A. 用装置甲进行中和热的测定
B. 用装置乙制取 CO2 气体
C. 用装置丙比较KMnO4、Cl2、S的氧化性强弱
D. 用装置丁模拟工业制氨气并检验产物
【答案】C
【解析】
A.图中缺少环形玻璃搅拌棒,则不能准确测定反应的最高温度,故A错误;
B.纯碱为粉末固体,与盐酸接触后关闭止水夹不能实现固液分离,不能制备少量气体,故B错误;
C.高锰酸钾与浓盐酸反应生成氯气,氯气与NaBr反应生成溴,由氧化剂的氧化性大于氧化产物的氧化性可知KMnO4、Cl2、Br2的氧化性强弱,故C正确;
D.氮气和氢气反应生成氨气,氨气可使湿润的红色石蕊试纸变蓝,则图中蓝色试纸不能检验氨气,故D错误;
故答案为C。

练习册系列答案
相关题目
【题目】下表是周期表的一部分,根据A~I在周期表中的位置,回答以下问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | J | F | H | I |
(1)表中元素,化学性质最不活泼的是__(用元素符号表示,本小题下同);被选做相对原子质量标准的核素是__(填核素符号);除稀有气体外,原子半径最大的是__,可用于制半导体材料的元素是__,形成化合物中种类最多的元素是__。
(2)最高价氧化物的水化物酸性最强的是__(填化学式),A分别与D、E、F、G、H形成的化合物中,最稳定的是__(填化学式)。
(3)B和H形成化合物的电子式为_。
(4)元素E和元素H的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式__。
(5)B、C两元素的最高价氧化物对应水化物之间反应的离子方程式是__。