题目内容
【题目】X、Y、Z、L、M五种元素的原子序数依次增大,X阴离子的电子数与Y原子的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的两种元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)L的元素名称为___________;五种元素的原子半径从小到大的顺序是(用元素符号表示)______________。
(2)Z、X两元素按原子数目比1∶3和2∶4构成分子A和B,用电子式表示A的形成过程_______________,B的结构式为________。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物化学式为________。
(4)一定条件下,M与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知该反应生成1 mol乙时放出536 kJ热量,其热化学方程式为____________________。
【答案】氧元素 H<O<N<C<Al ![]()
 34 H2SeO4 4Al(s)+3TiO2(s)+3C(s,石墨)=2Al2O3(s)+3TiC(s)ΔH=-1 072kJ·mol-1。
34 H2SeO4 4Al(s)+3TiO2(s)+3C(s,石墨)=2Al2O3(s)+3TiC(s)ΔH=-1 072kJ·mol-1。
【解析】
Y的最外层电子数是次外层电子数的2倍,推出Y为C,X阴离子的电子数与C原子内层电子数相等,则X为H,Z、L是空气中含量最多的两种元素,且原子序数依次增大,则Z为N,L为O,M是地壳中含量最高的金属元素,则M为Al,据此解答。
(1)根据上述推断,L为氧元素,半径一看电子层数,电子层数越多,半径最大,二看原子序数,电子层数相等,半径随着原子序数的递增而减小,因此是H<O<N<C<Al;
(2)A为NH3,B为N2H4,电子式形成的过程为: ,B的结构式为:
,B的结构式为: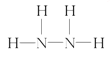 ;
;
(3)Se与O属于同一主族,且Se原子比O原子多两个电子层,则Se位于第四周期,原子序数16+18=34,最高价氧化物对应水化物化学式为H2SeO4;
(4)一定条件下,Al与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分,因此乙是氧化铝。已知该反应生成1 mol乙时放出536 kJ热量,所以热化学方程式为4Al(s)+3TiO2(s)+3C(s,石墨)=2Al2O3(s)+3TiC(s)ΔH=-1 072kJ·mol-1。

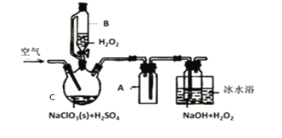
【题目】已知:CH3CH2CH2CH2OH![]() CH3CH2CH2CHO;利用如图装置用正丁醇合成正丁醛相关数据如表:
CH3CH2CH2CHO;利用如图装置用正丁醇合成正丁醛相关数据如表:
物质 | 沸点/℃ | 密度 / gcm-3 | 水中溶解性 |
|
正丁醇 | 117.2 | 0.8109 | 微溶 | |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是
A.为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B.当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
C.反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D.向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇