题目内容
【题目】Ⅰ. 砷化镓为第三代半导体,以其为材料制造的灯泡寿命长.耗能少。已知砷化镓的晶胞结构如图所示。请回答下列问题:
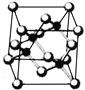
(1)下列说法正确的是__________(填序号)
A.砷化镓晶胞结构与NaCl相同 B.第一电离能 As>Ga
C.电负性 As>Ga D.原子半径 As>Ga
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为_____________________________;
(3)AsH3空间形状为___________;已知(CH3)3 Ga为非极性分子,则其中镓原子的杂化方式为____________;
Ⅱ. 金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(4)请解释金属铜能导电的原因_______________________, Cu2+的核外电子排布式为_______________________。
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有_________和_________。
【答案】 BC (CH3)3Ga + AsH3 ![]() GaAs + 3CH4 三角锥 sp2 铜是金属晶体,由金属阳离子和自由电子构成,自由电子在外加电场的作用下可发生定向移动 [Ar]3d9 或1s22s22p63s23p63d 9 离子键 配位键
GaAs + 3CH4 三角锥 sp2 铜是金属晶体,由金属阳离子和自由电子构成,自由电子在外加电场的作用下可发生定向移动 [Ar]3d9 或1s22s22p63s23p63d 9 离子键 配位键
【解析】(1)A项,GaAs晶体中As分布于晶胞体心,Ga分布于顶点和面心,而如图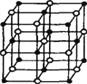 NaCl中阴阳离子分别位于晶胞的顶点、面心以及棱和体心,二者结构不同,故A错误;B项,同周期元素从左到右第一电离能逐渐增大,所以第一电离能:As>Ga,故B正确;C项,同周期元素从左到右电负性逐渐增大,所以电负性:As>Ga,故C正确;D项,同周期从左到右原子半径减小,所以原子半径As<Ga,故D错误。综上,选BC。
NaCl中阴阳离子分别位于晶胞的顶点、面心以及棱和体心,二者结构不同,故A错误;B项,同周期元素从左到右第一电离能逐渐增大,所以第一电离能:As>Ga,故B正确;C项,同周期元素从左到右电负性逐渐增大,所以电负性:As>Ga,故C正确;D项,同周期从左到右原子半径减小,所以原子半径As<Ga,故D错误。综上,选BC。
(2)由已知,反应物为(CH3)3Ga和AsH3,一种生成物为GaAs,根据原子守恒还应有CH4,反应在700℃下进行,化学方程式为:(CH3)3Ga+AsH3![]() GaAs+3CH4。
GaAs+3CH4。
(3)As原子最外层5个电子,AsH3中含有3个δ键和1个孤电子对,为三角锥形,Ga最外层3个电子,(CH3)3Ga中Ga形成3个δ键,没有孤电子对,为sp2杂化。
(4)金属铜能导电是因为铜是金属晶体,由金属阳离子和自由电子构成,自由电子在外加电场的作用下可发生定向移动,从而导电;Cu是29号,故Cu2+的核外电子排布式为[Ar]3d9或1s22s22p63s23p63d9。
(5)[Cu(NH3)4]SO4晶体属于配合物,配离子与硫酸根之间形成离子键、铜离子与氨分子之间形成配位键。

【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
(1)该反应的平衡常数表达式K= .
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下4个实验.
实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如表:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
A | 3mL乙醇、2mL乙酸、1mL 18molL﹣1浓H2SO4 | 饱和Na2CO3溶液 | 5.0 |
B | 3mL乙醇、2mL乙酸 | 0.1 | |
C | 3mL乙醇、2mL乙酸、6mL 3molL﹣1 H2SO4 | 1.2 | |
D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是mL和molL﹣1 .
②分析实验(填实验编号)的数据,可以推测出浓H2SO4的吸水性,提高了乙酸乙酯的产率.浓H2SO4的吸水性能够提高乙酸乙酯产率的原因是 .
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是 .




