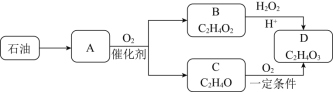
��Ŀ����
����Ŀ�����ݷ���ʽ3Cu+8HNO3(ϡ)=3Cu(NO3)2+2NO��+4H2O���ش��������⣺
��1����˫���ŷ���ʾ���ӵ�ת�Ƶķ�����Ŀ___��
��2���÷�Ӧ�е���������___����ԭ����__��
��3���÷�Ӧ�е�����������__����ԭ������__��
��4���÷�Ӧ��������ϡ�����������__��__��
��5�������Ϊ���ӷ�Ӧ����ʽ__��
��6���÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ__��
��7������Ӧ��ת�Ƶĵ��ӵ����ʵ�����0.9mol��������NO�����Ϊ__����״����������ԭ������Ϊ__mol��
��8��H2S+H2SO4(Ũ)=S��+SO2��+2H2O���ڸ÷�Ӧ��ÿһĦ��H2SO4�μӷ�Ӧ��ת�Ƶĵ��ӵ����ʵ���Ϊ____��
���𰸡�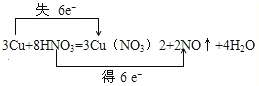 ���� ͭ ����ͭ NO ���� ������ 3Cu+8H++2NO3-=3Cu2++2NO��+4H2O 2��3 6.72 0.3 2mol
���� ͭ ����ͭ NO ���� ������ 3Cu+8H++2NO3-=3Cu2++2NO��+4H2O 2��3 6.72 0.3 2mol
��������
��˫���ű�ʾ����ת�ƣ������ҳ���Ӧ�������ı��Ԫ�أ����ϱ���ӵĵ���ʧ�� ������Ԫ�ػ��ϼ۵ı仯�����ҳ���������HNO3����ԭ����Cu������������Cu(NO3)2����ԭ������NO�������ڷ�Ӧ�������Ժ������ԣ���Ӧ���������뻹ԭ�������ʵ���֮��Ϊ2:3���������ͬ��Ԫ�ز�ͬ��̬֮��������������ԭ��Ӧ��Ԫ�صĻ��ϼ�ֻ���������棬H2S+H2SO4(Ũ)=S��+SO2��+2H2O�÷�Ӧ��ÿһĦ��H2SO4�μӷ�Ӧ��ת�Ƶĵ��ӵ����ʵ���Ϊ2 mol��
������Ԫ�ػ��ϼ۵ı仯�����ҳ���������HNO3����ԭ����Cu������������Cu(NO3)2����ԭ������NO�������ڷ�Ӧ�������Ժ������ԣ���Ӧ���������뻹ԭ�������ʵ���֮��Ϊ2:3���������ͬ��Ԫ�ز�ͬ��̬֮��������������ԭ��Ӧ��Ԫ�صĻ��ϼ�ֻ���������棬H2S+H2SO4(Ũ)=S��+SO2��+2H2O�÷�Ӧ��ÿһĦ��H2SO4�μӷ�Ӧ��ת�Ƶĵ��ӵ����ʵ���Ϊ2 mol��
��1��3Cu+8HNO3=3Cu(NO3)2+2NO��+4H2O��������ԭ��Ӧ����Ӧ��ʧ���ӵ�Ԫ����ͭԪ�أ����ϼ����ߣ��õ��ӵ�Ԫ���ǵ�Ԫ�أ����ϼ۽��ͣ���˫���ŷ���ʾ���ӵ�ת�Ƶķ�����ĿΪ�� ��
��
��2��������ָ�ڷ�Ӧ�еõ����ӻ��ϼ۽��͵ķ�Ӧ���ԭ��ָ�ڷ�Ӧ��ʧȥ���ӻ��ϼ����ߵķ�Ӧ���Ӧ�з�Ӧ���ͭԪ�صĻ��ϼ���0�ۣ�������Cu(NO3)2��ͭԪ�صĻ��ϼ�Ϊ+2�ۣ�ͭԪ�ػ��ϼ����ߣ���Cu�ǻ�ԭ������Ӧ�з�Ӧ��HNO3�е�Ԫ�صĻ��ϼ�Ϊ+5�ۣ�������NO�е�Ԫ�صĻ��ϼ�Ϊ+2�ۣ���Ԫ�ػ��ϼ۽��ͣ���HNO3����������
��3��������HNO3�ڷ�Ӧ�еõ����ӣ�����ԭ����NO����NO�ǻ�ԭ�����ԭ��Cu�ڷ�Ӧ��ʧȥ���ӣ�����������Cu(NO3)2������Cu(NO3)2�������
��4���ڷ�Ӧ�з�Ӧ��HNO3��һ���ֱ���ԭΪNO��һ����HNO3�еĵ�Ԫ��û�иı䣬������NO3- ��ʽ���ڣ��ʸ÷�Ӧ��������Ũ��������������ԡ������ԣ�
��5��Cu(NO3)2��HNO3����������ˮ��ǿ����ʣ���д���ӷ���ʽʱ������ӵ���ʽ��Cu�ǵ��ʡ�NO�������ﲢ�һ��Ƿǵ���ʡ�H2O�������ﲢ����������ʣ�������д���ӷ���ʽʱд�ɻ�ѧʽ����ͭ��ϡ���ᷴӦ�����ӷ���ʽΪ��3Cu+8H++2NO3-=3Cu2++2NO��+4H2O��
��6���ڷ�Ӧ������һ���������������á�һ�������������ã���Ӧ���������뻹ԭ�������ʵ���֮��Ϊ2:3��
��7���ڷ�Ӧ��ÿ����һ��NOת��3�����ӣ�����Ӧ��ת�Ƶĵ��ӵ����ʵ�����0.9mol������NO�����ʵ���Ϊ��0.9 mol ![]() 3=0.3 mol�����״��������NO�����Ϊ��
3=0.3 mol�����״��������NO�����Ϊ��
0.3 mol��22.4L��mol-1= 6.72L��
��8��H2S+H2SO4(Ũ)=S��+SO2��+2H2O��ͬ��Ԫ�ز�ͬ��̬֮��������������ԭ��Ӧ��Ԫ�صĻ��ϼ�ֻ���������棬��H2SO4��2e-��SO2�����Ը÷�Ӧ��ÿһĦ��H2SO4�μӷ�Ӧ��ת�Ƶĵ��ӵ����ʵ���Ϊ2 mol�� ![]()
![]()

 ���ſ����ϵ�д�
���ſ����ϵ�д� ���Ŀ����ϵ�д�
���Ŀ����ϵ�д� ������ӱ������ͯ������ϵ�д�
������ӱ������ͯ������ϵ�д�����Ŀ����1���ں��º��������£���һ����NO2��N2O4�Ļ������ͨ���ݻ�Ϊ2L���ܱ������У�������Ӧ2NO2(g)![]() N2O4(g)��H��0����Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ��ͼ��ʾ��
N2O4(g)��H��0����Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ��ͼ��ʾ��

��0��10min��ƽ����Ӧ���ʣ�v((NO2)=___________mol��L��1��min��1��
��a��b��c��d�ĸ����У���ʾ��ѧ��Ӧ����v(��)��v(��)�ĵ���___________��
��������Ӧ��Ӧ���е�25minʱ�������������ڳ���һ����NO2�����´ﵽƽ����������NO2�����������___________(������������������������С��)���÷�Ӧ��ƽ�ⳣ��K=___________(����������1λС��)��
��2��һ���¶��º��������У���Ӧ2N2O(g)![]() 2N2(g)+O2(g)���ڵ���������ʱ�ܴ�������N2O�ķֽ����ʣ���Ӧ����Ϊ��
2N2(g)+O2(g)���ڵ���������ʱ�ܴ�������N2O�ķֽ����ʣ���Ӧ����Ϊ��
��һ��I2(g)![]() 2I(g)(�췴Ӧ)
2I(g)(�췴Ӧ)
�ڶ���I(g)+N2O(g)��N2(g)+IO(g)(����Ӧ)
������IO(g)+N2O(g)��N2(g)+O2(g)+I(g)(�췴Ӧ)
ʵ�����������ʱN2O�ֽ����ʷ���v=k��c(N2O)��[c(I2)]0.5��kΪ���ʳ����������б�����ȷ����___________(����)��
a��N2O�ֽⷴӦ�У�k(����)>k(�⣩b����һ�����ܷ�Ӧ�������������
c���ڶ�����ܱȵ�������d��I2Ũ����N2O�ֽ�������
��3��F.Daniels�������ò�ѹ���ڸ��Է�Ӧ�����о���25��ʱN2O5(g)�ֽⷴӦ��
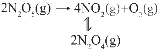
����NO2����ΪN2O4�ķ�Ӧ����Ѹ�ٴﵽƽ�⣬��ϵ����ѹǿp��ʱ��t�ı仯���±���ʾ��t=��ʱ��N2O5(g)��ȫ�ֽ⣩��
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | �� |
p/kPa | 36.0 | 40.5 | 42.6 | 45.9 | 49.2 | 61.2 | 62.3 | 64.0 |
��25��ʱ2NO2(g)![]() N2O4(g)��Ӧ��ƽ�ⳣ��Kp=___________kPa��1��
N2O4(g)��Ӧ��ƽ�ⳣ��Kp=___________kPa��1��
��t=200minʱ�������ϵ��p(N2O4)=6.5kPa�����ʱ��N2O5ת����Ϊ___________��(����������1λС��)