题目内容
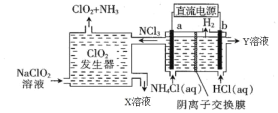
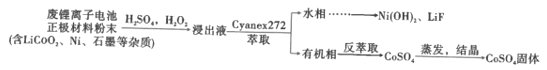
【题目】锂离子电池能够实现千余次充放电,但长时间使用后电池会失效,其中的化学试剂排放至环境中不仅会造成环境污染,还会造成资源的浪费。实验室模拟回收锂离子电池中的Co、Ni、Li的流程如图。
已知:LiCoO2难溶于水,易溶于酸。回答下列问题:
(1)LiCoO2中Co的化合价是__。
(2)LiCoO2在浸出过程中反应的离子方程式是__。
(3)浸出剂除了H2O2外,也可以选择Na2S2O3,比较二者的还原效率H2O2__(填“>”或“<”)Na2S2O3(还原效率:还原等物质的量的氧化剂消耗还原剂的物质的量)。
(4)提高浸出效率的方法有__。
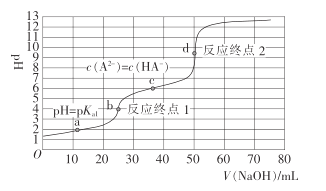
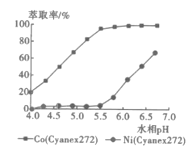
(5)利用Cyanex272萃取时,pH对钴、镍萃取分离效果的影响如图。从图中数据可知,用Cyanex272萃取分离时,最佳pH是__。
(6)反萃取的离子方程式为2H++CoR2=Co2++2HR,则反萃取剂的最佳选择是__。
(7)常温下,若水相中的Ni2+的质量浓度为1.18g·L-1,则pH=__时,Ni2+开始沉淀。[Ksp(Ni(OH)2=2×10-15]
(8)参照题中流程图的表达,结合信息设计完成从水相中分离Ni和Li的实验流程图(如图)___。
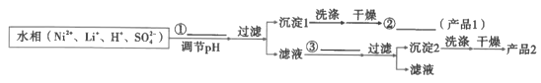
已知:
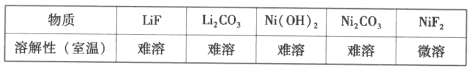
提供的无机试剂:NaOH、Na2CO3、NaF。
【答案】+3 2LiCoO2+6H++H2O2=2Co2++O2↑+2Li++4H2O < 适当升高温度,适当增加H2SO4浓度 5.5 H2SO4 7.5 ①NaOH ②Ni(OH)2 ③NaF
【解析】
(1)通过化合物中各元素化合价代数和为0进行计算;
(2)由流程图中有机相反萃取得到CoSO4,可知LiCoO2与H2O2在酸性条件下发生氧化还原反应,根据氧化还原反应的规律写出化学方程式;
(3)根据等物质的量H2O2和Na2S2O3作为还原剂转移电子的多少进行判断;
(4)提高浸出效率即提高化学反应速率;
(5)分离Co2+和Ni2+时,由于Co2+进入有机相,Ni进入水相,因此,应该选择钴的萃取率高而镍的萃取率低的pH范围;
(6)将钴洗脱进入水相中时,应该使反应向正反应方向移动,同时不能引入新杂质;
(7)根据Ksp(Ni(OH)2的表达式进行计算;
(8)根据表格中所给物质溶解度信息,调节pH应该用碱性物质,但要考虑分离Ni和Li元素不能使Ni和Li元素同时沉淀。
(1)LiCoO2中O元素为-2价,Li为+1价,根据化合物中各元素化合价代数和为0进行计算得Co的化合价为+3价;
(2)由流程图中有机相反萃取得到CoSO4,可知LiCoO2与H2O2在酸性条件下发生氧化还原反应,化学方程式为:2LiCoO2+6H++H2O2=2Co2++O2↑+2Li++4H2O;
(3)1molH2O2作为还原剂转移2mol电子,1molNa2S2O3作为还原剂转移8mol电子,则Na2S2O3的还原效率更高;
(4)提高浸出效率可以适当升高温度,适当增加H2SO4浓度等;
(5)分离Co2+和Ni2+时,由于Co2+进入有机相,Ni进入水相,因此,应该选择钴的萃取率高而镍的萃取率低的pH范围,所以最佳pH是5.5;
(6)将钴洗脱进入水相中时,应该使反应向正反应方向移动,同时,为不引入新杂质,反萃取剂最好选择H2SO4;
(7)c(Ni2+)=![]() mol/L=0.02mol/L,则开始沉淀时,c(OH-)=
mol/L=0.02mol/L,则开始沉淀时,c(OH-)=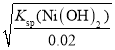 =
=![]() =10-6.5mol/L,则pH=14-6.5=7.5;
=10-6.5mol/L,则pH=14-6.5=7.5;
(8)根据表格中所给物质溶解度信息,调节pH应该用碱性物质,但要考虑分离Ni和Li元素不能使Ni和Li元素同时沉淀,所以选用NaOH,则Ni(OH)2先沉淀,过滤后滤液中加入NaF生成LiF沉淀。

 阅读快车系列答案
阅读快车系列答案