题目内容
10.下列说法或表示方法正确的是( )| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由H+(aq)+OH-(aq)=H2O(I);△H=-57.3kJ•mol-1molCH3COOH的稀溶液与含l mol NaOH的稀溶液混合,放出的热量小于57.3 kJ | |
| C. | 由C(石墨)=(金刚石);△H=+1.90kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | 500℃、30MPa下,将0.5 mol(g)和1.5 mol (g)置于密闭容器中充分反应生成(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g);△H=-38.6kJ•mol-1 |
分析 A、硫固体燃烧变化为蒸气需要吸收热量;
B、醋酸是弱酸存在电离平衡,电离过程是吸热过程;
C、物质能量越高越活泼;
D、0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,相同条件下的同一可逆反应,正逆反应反应热数值相等,符合相反.
解答 解:A、等物质的量的硫蒸气和硫固体分别完全燃烧,硫蒸气变化为固体放热,前者放出热量多,故A错误;
B、醋酸是弱酸存在电离平衡,电离过程是吸热过程,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ,故B正确;
C、由C(石墨)→C(金刚石)-1.90 kJ可知,石墨能量低,石墨比金刚石稳定,故C错误;
D、相同条件下的同一可逆反应,正逆反应反应热数值相等,符合相反,0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,所以2mol氨气分解,吸收的热量大于38.6kJ,故D错误;
故选B.
点评 本题考查反应能量变化,弱电解质电离平衡过程分析,燃烧热概念判断,注意能量越高越活泼,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.在空气中,有下列反应发生:①N2+O2═2NO;②2NO+O2═2NO2;③3NO2+H2O═2HNO3+NO;④2SO2+O2═2SO3;⑤SO3+H2O═H2SO4;⑥SO2+H2O═H2SO3;⑦3O2═2O3.其中属于氧化还原反应的是( )
| A. | ①②③④ | B. | ①②③④⑦ | C. | ①②④⑦ | D. | ①②③④⑤⑥⑦ |
15.已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
| A. | H2O(g)=H2(g)+$\frac{1}{2}$ O2(g)△H=+242 kJ/mol | B. | 2 H2(g)+O2(g)=2 H2O(g)△H=-484 kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$ O2(g)=H2O(g)△H=+242 kJ/mol | D. | 2 H2(g)+O2(g)=2 H2O(g)△H=+484 kJ/mol |
2.砹(At)是卤素中核电荷数最大的元素,下列推测中错误的是( )
| A. | 砹为有色固体 | B. | AgAt不溶于水 | ||
| C. | HAt 很稳定 | D. | 砹单质熔沸点比碘单质熔沸点高 |
19.如图为某品牌酱油标签的一部分.下列说法正确的是( )


| A. | 氨基酸态氮的含量是将有质量的重要指标,这些氨基酸是通过大豆中的蛋白质发生分解反应生成的 | |
| B. | 配料清单中的苯甲酸钠属于防腐剂 | |
| C. | 小麦中的主要营养物质是纤维素 | |
| D. | “铁强化酱油”可帮助预防缺铁性贫血,但过量服用补铁剂也可能引起铁中毒 |
20.下列叙述正确的是( )
| A. | 胶体区别于其他分散系的根本原因是胶体有丁达尔效应 | |
| B. | 氯化铁溶液加入到冷水中可以制得氢氧化铁胶体 | |
| C. | 分散系中分散质粒子直径由小到大的正确顺序是:溶液<胶体<浊液 | |
| D. | 胶体的分散质可以通过过滤从分散剂中分离出来 |
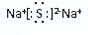 ,所含化学键类型离子键;
,所含化学键类型离子键;