题目内容
15.已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )| A. | H2O(g)=H2(g)+$\frac{1}{2}$ O2(g)△H=+242 kJ/mol | B. | 2 H2(g)+O2(g)=2 H2O(g)△H=-484 kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$ O2(g)=H2O(g)△H=+242 kJ/mol | D. | 2 H2(g)+O2(g)=2 H2O(g)△H=+484 kJ/mol |
分析 书写或判断热化学方程式应注意以下三点:①热化学方程式的右侧注明热量的变化,△H<0放热,△H>0吸热.②注明各物质的聚集状态(气-g,液-l,固-s),③各物质前面的系数表示物质的量,由此分析解答.
解答 解:A、1mol氢气完全燃烧生成水蒸气时放出的热量为:484 kJ÷2=242 kJ,由于H2O的分解与化合,反应方向相反,故吸热与放热的数值相等,故A正确;
B、表示2mol氢气燃烧生成水蒸气放出484kJ热量,故B正确;
C、是放热反应,△H<0,故C错误;
D、氢气在氧气中燃烧是放热反应,所以△H<0,故D错误;
故选AB.
点评 本题是考查热化学方程式的书写的正误判断,学生只要掌握书写热化学方程的注意点,就可以迅速解题,比较容易.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
6.决定气体体积的主要因素是( )
①微粒的大小 ②微粒的数目 ③微粒之间的距离.
①微粒的大小 ②微粒的数目 ③微粒之间的距离.
| A. | ①② | B. | ①③ | C. | ②③ | D. | ①②③ |
10.下列说法或表示方法正确的是( )
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由H+(aq)+OH-(aq)=H2O(I);△H=-57.3kJ•mol-1molCH3COOH的稀溶液与含l mol NaOH的稀溶液混合,放出的热量小于57.3 kJ | |
| C. | 由C(石墨)=(金刚石);△H=+1.90kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | 500℃、30MPa下,将0.5 mol(g)和1.5 mol (g)置于密闭容器中充分反应生成(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g);△H=-38.6kJ•mol-1 |
20.某陨石中含有镁的一种放射性同位素${\;}_{12}^{28}Mg$,该同位素的原子核内的中子数是( )
| A. | 16 | B. | 14 | C. | 12 | D. | 28 |
5.2011年5月24日,台湾地区有关方面向国家质检总局通报,发现部分饮品中用于分散乳化油脂的食品添加剂“起云剂”中含有禁用物质“塑化剂”.起云剂常见原料是阿拉伯胶、乳化剂、棕榈油或葵花油,祸首台湾昱伸公司制造起云剂时偷梁换柱,用塑化剂取代成本贵5倍的棕榈油以图牟取暴利,与工业酒精勾兑、苏丹红、三聚氰胺事件类同,是极其恶劣的制假行为和严重的食品安全事件.塑化剂中最常见为邻苯二甲酸二(2-乙基己基)酯,简称DOP或DEHP,可用乙醛与邻苯二甲酸酸酐分步合成制得,路线如下图.
(1)2CH3CHO$→_{①}^{NaOH}$CH3CH(OH)CH2CHO$→_{②}^{-H_{2}O}$CH3CH=CHCH0$\stackrel{③}{→}$CH3CH2CH2CH0
(2)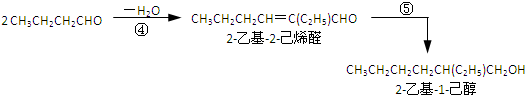
(3)利用邻苯二甲酸酸酐与2-乙基-1-己醇合成DEHP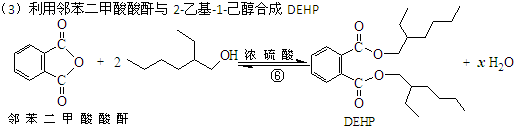
下列说法正确的是( )
(1)2CH3CHO$→_{①}^{NaOH}$CH3CH(OH)CH2CHO$→_{②}^{-H_{2}O}$CH3CH=CHCH0$\stackrel{③}{→}$CH3CH2CH2CH0
(2)

(3)利用邻苯二甲酸酸酐与2-乙基-1-己醇合成DEHP

下列说法正确的是( )
| A. | 合成过程涉及加成、消去、酯化、聚合等类型的有机反应 | |
| B. | 步骤(1)中②反应发生的条件是在NaOH/醇溶液中加热,反应类型是消去反应 | |
| C. | 步骤(1)(2)连续操作时,③、⑤消耗H2物质的量相等 | |
| D. | ⑥反应方程式中产物H2O系数x=2,及时除去⑥中反应釜内的水可提高DEHP产率 |
 )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下: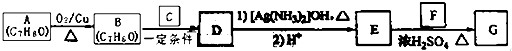 已知以下信息:
已知以下信息: ;
; +CH3CHO$\stackrel{一定条件}{→}$
+CH3CHO$\stackrel{一定条件}{→}$ +H2O.
+H2O. +(CH3)2CHCH2CH2OH$→_{△}^{浓硫酸}$
+(CH3)2CHCH2CH2OH$→_{△}^{浓硫酸}$ +H2O,反应类型为酯化反应.
+H2O,反应类型为酯化反应. W、X、Y、Z、R是五种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10.X和Ne原子的核外电子数相差1.Y的最高价氧化物对应水化物是医用胃酸中和剂中的一种.R和W具有相同的最外层电子数.Z在同周期主族元素中原子半径最小.
W、X、Y、Z、R是五种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10.X和Ne原子的核外电子数相差1.Y的最高价氧化物对应水化物是医用胃酸中和剂中的一种.R和W具有相同的最外层电子数.Z在同周期主族元素中原子半径最小. 气体A是石油裂解的主要产物之一,其相对分子质量为28,C是一中气体,E是一种高分子化合物.A、B、C、D、E在一定条件下存在如图转化关系(部分反应条件、产物被省略)
气体A是石油裂解的主要产物之一,其相对分子质量为28,C是一中气体,E是一种高分子化合物.A、B、C、D、E在一定条件下存在如图转化关系(部分反应条件、产物被省略)