题目内容
18.常温时,向pH=2的硫酸中加入等体积的下列溶液后,滴入甲基橙试液,出现红色,该溶液可能是( )| A. | pH=12 的Ba(OH)2 | B. | pH=12的氨水 | C. | 0.005mol/L NaOH | D. | 0.05mol/L BaCl2 |
分析 滴入甲基橙试液,出现红色,溶液pH<3.1,以此进行计算.
解答 解:A.pH=2的硫酸与pH=12的Ba(OH)2恰好完全反应,溶液呈中性,滴入甲基橙试液,出现黄色,故A错误;
B.向pH=2的硫酸中加入等体积的PH=12的氨水,氨水过量,反应后溶液呈碱性,滴入甲基橙试液,出现黄色,故B错误;
C.反应后c(H+)=$\frac{0.01mol/L×VL-0.005mol/L×VL}{2VL}$=0.0025mol/L>10-3.1mol/L,滴入甲基橙试液,出现红色,故C正确;
D.向pH=2的硫酸中加入0.05 mol/L BaCl2,c(H+)=0.005mol/L>10-3.1mol/L,滴入甲基橙试液,出现红色,故D正确.
故选CD.
点评 本题考查pH的计算,题目难度不大,注意甲基橙的变色范围,把握相关物理量的计算.

练习册系列答案
相关题目
19.已知Br2在有机溶剂中的溶解度比在水中的大,下列有机溶剂能从溴水中萃取溴的是( )
| A. | 酒精 | B. | 乙酸 | C. | 四氯化碳 | D. | 汽油 |
9.下列各组中的三种微粒,所含质子数与电子数都相等的是( )
| A. | Na+、Mg2+、Al3+ | B. | HCl、H2S、Ar | C. | H2O、OH-、Na+ | D. | NH4+、Na+、F- |
6.过量的锌粉与一定量的稀盐酸反应,为了加快反应速率,但是又不影响生成的氢气总量,可以采取的措施是( )
| A. | 适当升高温度 | B. | 加入适量的水 | ||
| C. | 加入少量CuSO4溶液 | D. | 加入浓度较大的硝酸 |
13.下列关于胶体的说法正确的是( )
| A. | 胶体与溶液有明显不同的外观特征,胶体呈胶状 | |
| B. | 胶体不稳定,静置后容易产生沉淀 | |
| C. | 将Fe(OH)3胶体进行过滤,所得滤液与原来胶体组成是不同的 | |
| D. | 豆浆是胶体,因为豆浆中的分散质粒子直径介于1nm-100nm之间 |
10.区别植物油和矿物油的正确方法是( )
| A. | 加水振荡,观察是否有分层现象 | |
| B. | 加乙醇振荡,观察是否发生分层 | |
| C. | 加新制Cu(OH)2悬浊液,煮沸,观察有无砖红色沉淀生成 | |
| D. | 加入含有酚酞的NaOH溶液,加热,观察红色是否变浅 |
7.下列四个选项的描述正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | CH3C(CH3)2CH2CH2CH(CH2CH3)CH3 的系统命名为:2,2,5-三甲基庚烷 | |
| C. | 羟基的电子式: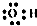 | |
| D. | CCl4的电子式: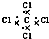 |
8.下列关于18O示踪原子的踪迹判断错误的是( )
| A. | 2KMnO4+5H218O2+3H2SO4═K2SO4+2MnSO4+518O2+8H2O | |
| B. | CH3COOH+H18OC2H5$→_{△}^{浓硫酸}$CH3CO18OC2H5+H2O | |
| C. | CH3CH218OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H218O | |
| D. | C6H518OH+NaOH→C6H518ONa+H2O |
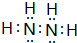 .
.