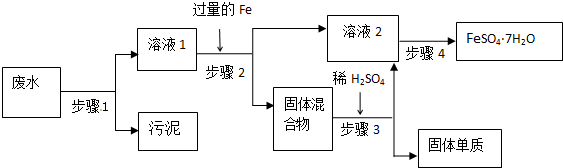
题目内容
6.将一定质量的铁投入20mL浓硫酸中,加热充分反应后固体有剩余并收集气体4.48L(标准状况),质量为6.6g;则(1)参加反应的铁的质量为11.2g.
(2)硫酸溶液的物质的量浓度为15mol/L.
分析 反应后固体有剩余,加热发生Fe+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$FeSO4+2H2O+SO2↑,n(气体)=$\frac{4.48L}{22.4L/mol}$=0.2mol,若气体为二氧化硫其质量为0.2mol×64g/mol=12.8g>6.6g,则还发生Fe+H2SO4(稀)$\frac{\underline{\;\;△\;\;}}{\;}$FeSO4+H2↑,结合物质的量关系及质量关系计算.
解答 解:反应后固体有剩余,加热发生Fe+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$FeSO4+2H2O+SO2↑,n(气体)=$\frac{4.48L}{22.4L/mol}$=0.2mol,若气体为二氧化硫其质量为0.2mol×64g/mol=12.8g>6.6g,则还发生Fe+H2SO4(稀)$\frac{\underline{\;\;△\;\;}}{\;}$FeSO4+H2↑,
设二氧化硫、氢气的物质的量分别为x、y,则
$\left\{\begin{array}{l}{x+y=0.2}\\{64x+2y=6.6}\end{array}\right.$
解得x=0.1mol,y=0.1mol,
(1)由反应可知,n(Fe)=n(SO2)+n(H2)=0.2mol,其质量为0.2mol×56g/mol=11.2 g,故答案为:11.2 g;
(2)由反应可知,n(H2SO4)=2n(SO2)+n(H2)=0.3mol,则硫酸溶液的物质的量浓度为$\frac{0.3mol}{0.02L}$=15 mol/L,故答案为:15 mol/L.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应及物质的、质量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

| A. | 断开1个N≡N键的同时有6个N-H键生成 | |
| B. | 混合气体的密度不变 | |
| C. | 混合气体的平均相对分子质量不变 | |
| D. | N2、H2、NH3分子数之比为1:3:2的状态 |
| A. | H2SO4→MgSO4 | B. | NaCl→Cl2 | C. | CuSO4→Cu | D. | HClO→Cl2 |
 一定温度下,两个体积相等的连通容器用活塞分开,左右两室各充入一定量NO和O2,恰好使两容器内气体密度相同,打开活塞,充分混合反应.下列判断正确的是(不考虑NO2转化为N2O4)( )
一定温度下,两个体积相等的连通容器用活塞分开,左右两室各充入一定量NO和O2,恰好使两容器内气体密度相同,打开活塞,充分混合反应.下列判断正确的是(不考虑NO2转化为N2O4)( )| A. | 最终容器内无O2存在 | B. | 反应前、后左室气体压强不变 | ||
| C. | 反应前、后右室气体密度不变 | D. | 开始时左右两室气体分子数相同 |
| A. | CH2O和CO2分子中的中心原子均采用sp2杂化 | |
| B. | CH3SH 的相对分子质量比CH3OH大,因此前者的沸点高 | |
| C. | C6H6分子中含有6个σ键和1个大π键,C6H6是非极性分子 | |
| D. | 甲胺(分子式CH3NH2)的沸点比三甲胺[分子式(CH3)3N]的沸点高 |
| A. | 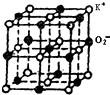 如图一个超氧化钾小晶胞中含有4个KO2 | |
| B. | 和K+距离相同且最近的O2-构成的多面体是正六面体 | |
| C. | 和K+距离相同且最近的K+有8个 | |
| D. | 和K+距离相同且最近的O2-共有8个 |
| A. | 用溴水或酸性KMnO4溶液鉴别甲烷和乙烯 | |
| B. | 向酒精中加入足量生石灰检验酒精中是否含有少量水 | |
| C. | 在盛有2mL无水乙醇的试管中放入绕成螺旋状的光洁铜丝,加热可制得乙醛 | |
| D. | 将裂解气通入到酸性KMnO4溶液中来证明裂解气中是否有乙烯 |
N2(g)+3H2(g)?2NH3(g)
起始浓度(mol•L-1):1.0 3.0 0.2
2s末浓度(mol•L-1):0.6 1.8 1.0
4s末浓度(mol•L-1):0.4 1.2 1.4
当用氨气浓度的增加来表示该反应的化学反应速率时,下列说法错误的是( )
| A. | 2~4 s内的平均反应速率为0.2 mol•L-1•s-1 | |
| B. | 前4 s内的平均反应速率为0.3 mol•L-1•s-1 | |
| C. | 前2 s内的平均反应速率为0.4 mol•L-1•s-1 | |
| D. | 2 s末的反应速率为0.4 mol•L-1•s-1 |