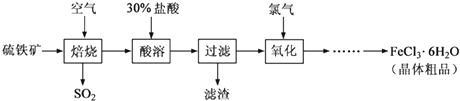
题目内容
14.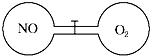 一定温度下,两个体积相等的连通容器用活塞分开,左右两室各充入一定量NO和O2,恰好使两容器内气体密度相同,打开活塞,充分混合反应.下列判断正确的是(不考虑NO2转化为N2O4)( )
一定温度下,两个体积相等的连通容器用活塞分开,左右两室各充入一定量NO和O2,恰好使两容器内气体密度相同,打开活塞,充分混合反应.下列判断正确的是(不考虑NO2转化为N2O4)( )| A. | 最终容器内无O2存在 | B. | 反应前、后左室气体压强不变 | ||
| C. | 反应前、后右室气体密度不变 | D. | 开始时左右两室气体分子数相同 |
分析 由左右两室体积相同,两容器内气体密度相同可知,两容器中气体的质量一定相等,再结合n=$\frac{m}{M}$可知NO和O2的物质的量之比为32g/mol:30g/mol=16:15.
A.发生反应:2NO+O2=2NO2,根据方程式判断;
B.发生2NO+O2=2NO2,反应后总的物质的量减少,故反应后左室的气体物质的量要减小;
C.气体的总质量为原来一氧化氮与氧气质量之和,为氧气质量的2倍,体积为左右两室的体积之和,为右室室的2倍,故密度不变;
D.气体分子数目之比等于物质的量之比.
解答 解:由左右两室体积相同,两容器内气体密度相同可知,两容器中气体的质量一定相等,再结合n=$\frac{m}{M}$可知NO和O2的物质的量之比为32g/mol:30g/mol=16:15.
A.NO和O2的物质的量之比为16:15,发生反应:2NO+O2=2NO2,O2过量,故最终容器内有O2存在,故A错误;
B.发生2NO+O2=2NO2,反应后总的物质的量减少,平均充满左右两室,故反应后左室的气体物质的量要减小,故压强减小,故B错误;
C.反应后气体的总质量为原来一氧化氮与氧气质量之和,为氧气质量的2倍,体积为左右两室的体积之和,为右室的2倍,故密度不变,故C正确;
D.NO和O2的物质的量之比为16:15,气体分子数目之比等于物质的量之比,开始时左右两室分子数不相同,故D错误,
故选C.
点评 本题考查阿伏伽德罗定律及推论、化学计算等,难度中等,侧重考查学生分析计算能力,注意二者发生反应物质的量减小.

练习册系列答案
相关题目
19.下列分离或提纯物质的方法正确的是( )
| A. | 用蒸发法进行海水淡化 | |
| B. | 用酒精萃取碘水中的碘 | |
| C. | 用渗析的方法除去淀粉溶液中含有的少量NaCl | |
| D. | 用加热→蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |
5.某无色透明的溶液能够与铝作用生成氢气,则在此溶液中一定能大量共存的离子组是( )
| A. | HCO3-、NO3-、Ba2+、Cl- | B. | Na+、Ba2+、Cl-、NO3- | ||
| C. | K+、NH4+、Cl-、OH- | D. | Na+、K+、SO42-、I- |
2.氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;还原剂的还原性大于还原产物的还原性.现有以下反应( )
①Cl2+2KBr═2KCl+Br2,②KClO3+6HCl═3Cl2+KCl+3H2O,③2KBrO3+Cl2═Br2+2KClO3,
下列说法正确的是.
①Cl2+2KBr═2KCl+Br2,②KClO3+6HCl═3Cl2+KCl+3H2O,③2KBrO3+Cl2═Br2+2KClO3,
下列说法正确的是.
| A. | 上述三个反应都有单质生成,所以都是置换反应 | |
| B. | 氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 | |
| C. | 反应②中还原剂与氧化剂的物质的量之比为6:1 | |
| D. | ③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol |
9.Ⅰ.短周期元素X、Y、Z、W在元素周期表中相对位置如表所示.其中Y所处的周期序数与族序数相等.按要求回答下列问题:
(1)写出X的原子结构示意图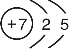 .
.
(2)W与Z的氢化物中,较稳定的是HCl(用化学式表示)
(3)含Y的某种盐常用作净水剂,其净水原理是Al3+3H2O?Al(OH)3(胶体)+3H+(用离子方程式表示)
Ⅱ.运用所学化学原理,解决下列问题:
(4)已知:Si+2NaOH+H2O=Na2SiO3+2H2↑.某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为Si+6OH--4e-=SiO32-+3H2O;
(5)已知:①C(s)+O2(g)=CO2(g)△H1;
②CO2(g)+C(s)=2CO(g)△H2;
③Si(s)+O2(g)=SiO2(s)△H3.
工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)=Si(s)+2CO(g)△H=△H1+△H2-△H3;
(6)25℃时,往a mol•L-1NH3的水溶液中滴加0.1mol•L-1H2SO4溶液,滴加过程中溶液的导电能力增强(填“增强”、“减弱”或“不变”);实验测得a mol•L-1NH3的水溶液的pH值为12,求此氨水的电离平衡常数Kb=$\frac{1{0}^{-4}}{(a=1{0}^{-2})}$mol•L-1(用含a的代数式表示).
| X | ||||
| Y | Z | W |
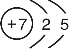 .
.(2)W与Z的氢化物中,较稳定的是HCl(用化学式表示)
(3)含Y的某种盐常用作净水剂,其净水原理是Al3+3H2O?Al(OH)3(胶体)+3H+(用离子方程式表示)
Ⅱ.运用所学化学原理,解决下列问题:
(4)已知:Si+2NaOH+H2O=Na2SiO3+2H2↑.某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为Si+6OH--4e-=SiO32-+3H2O;
(5)已知:①C(s)+O2(g)=CO2(g)△H1;
②CO2(g)+C(s)=2CO(g)△H2;
③Si(s)+O2(g)=SiO2(s)△H3.
工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)=Si(s)+2CO(g)△H=△H1+△H2-△H3;
(6)25℃时,往a mol•L-1NH3的水溶液中滴加0.1mol•L-1H2SO4溶液,滴加过程中溶液的导电能力增强(填“增强”、“减弱”或“不变”);实验测得a mol•L-1NH3的水溶液的pH值为12,求此氨水的电离平衡常数Kb=$\frac{1{0}^{-4}}{(a=1{0}^{-2})}$mol•L-1(用含a的代数式表示).
19.下列原子构成的单质中既能与稀硫酸反应又能与烧碱溶液反应,都产生H2的是( )
| A. | 核内无中子的原子 | |
| B. | 价电子构型为3s23p1 | |
| C. | 最外层电子数等于倒数第三层上的电子数的原子 | |
| D. | N层上无电子,最外层上的电子数等于电子层数的原子 |
6.将一定质量的铁投入20mL浓硫酸中,加热充分反应后固体有剩余并收集气体4.48L(标准状况),质量为6.6g;则
(1)参加反应的铁的质量为11.2g.
(2)硫酸溶液的物质的量浓度为15mol/L.
(1)参加反应的铁的质量为11.2g.
(2)硫酸溶液的物质的量浓度为15mol/L.
4.已知蓄电池在放电时起原电池的作用,充电时起电解他的作用.铅蓄电池在放电和充电时发生的化学反应可用下式表示:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O据此判断下列叙述中正确的是( )
| A. | 在放电时,正极发生的反应是Pb(s)+SO42-(ag)-2e-═PbSO4(s) | |
| B. | 在充电时,电池中硫酸的浓度不断变小 | |
| C. | 在充电时,阴极发生的反应是PbSO4(s)+2e-═Pb(s)+SO42-(ag) | |
| D. | 在放电时,该电池的负极材料是氧化铅 |