题目内容
【题目】如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。
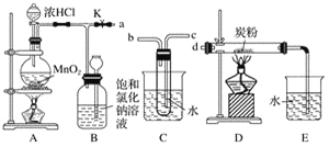
(1)①盛装浓盐酸的仪器名称为___,盛装二氧化锰的仪器名称为___。
②请写出装置A中发生反应的化学方程式___。
③标准状况下,上述反应每生成2.24L氯气,转移电子的物质的量为___mol。
(2)要将C装置接入B和D之间,正确的接法是:a→___→___→d。
(3)实验开始先点燃A处的酒精灯,打开活塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为___。
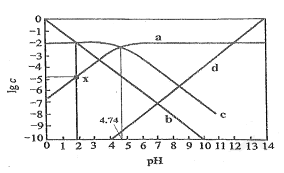
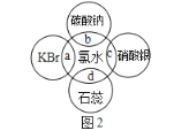
(4)氯水中含有多种成分,因而具有很多性质,根据氯水分别与如图2所示四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量)。
①能证明氯水具有漂白性的是___(填“a”“b”“c”或“d”)。
②c过程中的现象是___。
【答案】分液漏斗 圆底烧瓶 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 0.2 c b 2Cl2+C+2H2O
MnCl2+Cl2↑+2H2O 0.2 c b 2Cl2+C+2H2O![]() 4HCl+CO2 d 产生白色沉淀
4HCl+CO2 d 产生白色沉淀
【解析】
装置A发生的反应:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;图2中氯气与水的反应: Cl2+H2O
MnCl2+Cl2↑+2H2O;图2中氯气与水的反应: Cl2+H2O![]() HCl+HClO,次氯酸具有漂白性,有氯离子能与银离子产生白色沉淀。
HCl+HClO,次氯酸具有漂白性,有氯离子能与银离子产生白色沉淀。
(1)①盛装浓盐酸的仪器名称为:分液漏斗;盛装二氧化锰的仪器名称为:圆底烧瓶;
②装置A是制取氯气的反应,化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
③标准状况下,生成2.24L氯气,即生成0.1molCl2,由②中的化学方程式可知,每生成1molCl2,转移2mol电子,故每生成2.24L氯气,转移电子的物质的量为0.2mol
(2)由装置图判断判断,气体由B流经C进入到D中反应,气体通过盛有水的试管时应长进短出,否则不能通过C装置,即正确的连接方法是a→c→b→d,故答案为:c;b;
(3)由题意知反应为Cl2、C、H2O,生成物为HCl和CO2,则反应的化学方程式为:2Cl2+C+2H2O![]() 4HCl+CO2;
4HCl+CO2;
(4) ①氯水含有次氯酸,具有漂白性,能够使石蕊溶液褪色;
②氯水含有氯离子,与硝酸银反应生成氯化银沉淀;故答案为:d;产生白色沉淀。