题目内容
【题目】在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列表述中正确的是
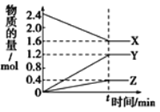
A. 反应的化学方程式为2X=3Y+Z
B. 若t=4,则0~t的X的化学反应速率为0.1mol·L-1·min-1
C. t时,正、逆反应都不再继续进行,反应达到平衡状态
D. 温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率都增大
【答案】B
【解析】分析:A、根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式,注意该反应为可逆反应,应该用可逆号;B、根据平衡状态的特征进行回答;C、根据v=![]() 来计算;D、根据压强的变化和浓度变化对反应速率的影响关系来判断。
来计算;D、根据压强的变化和浓度变化对反应速率的影响关系来判断。
详解:A、由图象可以看出,反应中X物质的量减小,Y、Z的物质的量增多,则X为反应物,Y、Z为生成物,且![]() ,则该反应的化学方程式为:2X3Y+Z,故A错误;
,则该反应的化学方程式为:2X3Y+Z,故A错误;
B、若t=4,则0~t的X的化学反应速率为![]() =0.1mol·L-1·min-1,所以B选项是正确的;
=0.1mol·L-1·min-1,所以B选项是正确的;
C、t时,正、逆反应继续进行,反应达到化学平衡,是动态平衡,故C错误;
D、温度、体积不变,t时刻充入1molHe使压强增大,正、逆反应速率不变,故D错误。
所以B选项是正确的。

【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下:

已知:
①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)酸浸时,为了提高浸取率可采取的措施有_________________(写出两条)。
(2)过滤操作时所用玻璃仪器除烧杯外,还需要________________。
(3)H2O2的作用是将滤液I中的Cr3+转化为C2O72-,该反应的离子方程式为:____________________。
(4)加入NaOH溶液调节溶液pH=8,既可以使溶液中某些杂质离子转化为沉淀,同时又可以将Cr2O72-转化为________(填微粒的化学式),当溶液的pH>8时,沉淀的主要成份为________ (填化学式)。
(5)钠离子交换树脂的反应原理为:Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有________________,交换后溶液中浓度明显增大的离子为________________。
