题目内容
12.下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素.请填写下列空白:(涉及到元素和物质的,用元素符号或化学式填空)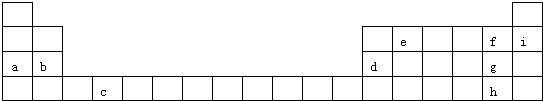
(1)元素c在元素周期表中的位置是第四周期ⅣB族;
(2)化学性质最不活泼的元素的原子结构示意图为
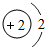 ;
;(3)a、b、d、g四种元素的原子半径从小到大的顺序是Cl<AI<Mg<Na,离子半径从小到大的顺序是AI3+<Mg2+<Na+<Cl-;
(4)f、g、h为同一主族元素,它们的非金属性强弱由大到小的顺序是F>Cl>Br,请写出一个可以证明g和h的非金属性强弱关系的离子方程式Cl2+2Br-=2Cl-+Br2.
分析 由元素在周期表中的位置可知,a为Na,b为Mg,c为Ti,d为Al,e为C,f为F,g为Cl,h为Br,i为He,
(1)根据元素周期表族排列的方式,周期表第四列应为ⅣB;
(2)以上元素中,化学性质最不活泼的元素为稀有气体元素He;
(3)电子导数越多,原子半径越大,电子导数相同时,核电荷数越多,原子半径越小,离子半径也可以用此方法比较;
(4)同主族元素从上向下非金属性逐渐减弱,可以根据单质之间的置换来证明非金属性强弱关系.
解答 解:由元素在周期表中的位置可知,a为Na,b为Mg,c为Ti,d为Al,e为C,f为F,g为Cl,h为Br,i为He,
(1)根据元素周期表族排列的方式,周期表第四列应为ⅣB,
故答案为:ⅣB;
(2)以上元素中,化学性质最不活泼的元素为稀有气体元素He,其原子结构示意图为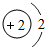 ,
,
故答案为: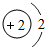 ;
;
(3)电子导数越多,原子半径越大,电子导数相同时,核电荷数越多,原子半径越小,离子半径也可以用此方法比较,所以a、b、d、g四种元素的原子半径从小到大的顺序是 Cl<AI<Mg<Na,离子半径从小到大的顺序是AI3+<Mg2+<Na+<Cl-,
故答案为:Cl<AI<Mg<Na;AI3+<Mg2+<Na+<Cl-;
(4)同主族元素从上向下非金属性逐渐减弱,所以f、g、h的非金属性强弱由大到小的顺序是F>Cl>Br,证明g和h的非金属性强弱关系可以利用单质之间的置换来证明,反应的离子方程式为Cl2+2Br-=2Cl-+Br2,
故答案为:F>Cl>Br;Cl2+2Br-=2Cl-+Br2.
点评 本题考查元素周期表和元素周期律,明确元素的推断是解答本题的关键,注意元素及其单质、化合物的性质,题目难度不大.

练习册系列答案
相关题目
4.下列各组溶液,只用试管和胶头滴管,不用任何试剂就可以鉴别的是( )
| A. | H2SO4和NaHCO3 | B. | KOH和Al2(SO4)3 | C. | CaCl2和Na2CO3 | D. | Ba(OH)2和NaHSO4 |
5.在酸性高锰酸钾溶液中加入过氧化钠粉末,溶液褪色,其中发生反应的离子方程式为:2MnO${\;}_{4}^{-}$+16H++5Na2O2═2Mn2++5O2↑+8H2O+10Na+.下列判断正确的是( )
| A. | O2是还原产物,Mn2+是氧化产物 | |
| B. | Na2O2既是氧化剂,又是还原剂 | |
| C. | 标准状况下,产生22.4L O2时反应转移2mol e- | |
| D. | 通常用浓盐酸酸化高锰酸钾溶液 |
2.有铝片、铁片、铜片三种金属片,只利用下列某种试剂或方法无法将它们区别开的是( )
| A. | 盐酸 | B. | 醋酸 | C. | NaOH溶液 | D. | 观察法 |
7.700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)反应过程中测定的部分数据见表(表中t1>t2):
依据题意回答下列问题:
(1)反应在t1min内的平均速率为v(H2)=$\frac{0.20}{{t}_{1}}$mol•L-1•min-1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时,n(CO2)=0.40mol.
(3)保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大(填“增大”或“减小”或“不变”),H2O的体积分数增大(填“增大”或“减小”或“不变”).
(4)温度升至800℃,上述反应平衡常数为0.64,则正反应为放热反应(填“放热”或“吸热”).
(5)700℃时,向容积为2L的密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,则平衡向正移动(正、逆、不).
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
(1)反应在t1min内的平均速率为v(H2)=$\frac{0.20}{{t}_{1}}$mol•L-1•min-1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时,n(CO2)=0.40mol.
(3)保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大(填“增大”或“减小”或“不变”),H2O的体积分数增大(填“增大”或“减小”或“不变”).
(4)温度升至800℃,上述反应平衡常数为0.64,则正反应为放热反应(填“放热”或“吸热”).
(5)700℃时,向容积为2L的密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,则平衡向正移动(正、逆、不).
17.下列说法正确的是( )
| A. | 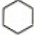 属于饱和烃 属于饱和烃 | |
| B. | 化合物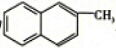 是苯的同系物 是苯的同系物 | |
| C. | 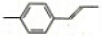 分子中碳原子一定共平面 分子中碳原子一定共平面 | |
| D. | 除甲酸外的羧酸均不能使酸性高锰酸钾溶液褪色 |
4.下列离子组一定能大量共存的是( )
| A. | 酚酞为无色的溶液:I-、CH3COO-、NO3-、Na+ | |
| B. | 甲基橙呈黄色的溶液中:Na+、CO32-、NO3-、NH4+ | |
| C. | 含大量Al3+的溶液中:K+、Na+、S2-、NO3- | |
| D. | pH>7的溶液中:CO32-、Cl-、F-、K+ |
1.下列说法正确的是( )
| A. | 明矾既可用于净水,也可杀菌消毒 | |
| B. | 溴乙烷与NaOH的乙醇溶液共热生成乙烯 | |
| C. | 糖类、油脂和蛋白质都是天然高分子化合物 | |
| D. | 用福尔马林(甲醛溶液)浸泡海产品,可长时间保鲜 |
2.如何除掉粗盐中的可溶性杂质CaCl2、MgCl2、Na2SO4?
(1)
(2)若试剂过量,则加入的顺序为:(写出一种顺序即可)NaOH、BaCl2、Na2CO3、HCl或BaCl2、NaOH、Na2CO3、HCl.
(1)
| 杂质 | 加入试剂 | 离子方程式 |
| Na2SO4 | ||
| MgCl2 | ||
| CaCl2 |