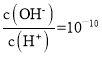题目内容
【题目】25℃时,向某二元弱酸H2X的钠盐溶液中滴加盐酸,混合溶液中离子浓度与pH的关系如图所示,其中lgX =lgc(X2-)/ c(HX-) 或lgc(HX-)/c(H2X)。下列叙述不正确的是
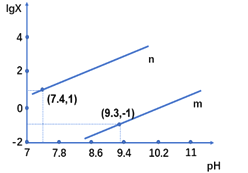
A. 当溶液呈中性时, c(HX-)>c(X2-)>c(H2X)
B. 曲线m表示lgc(X2-)/c(HX-)与pH的变化关系
C. Ka1(H2X)的数量级为10-7
D. 25℃时,NaHX溶液中:c(OH-)>c(H+)
【答案】A
【解析】
H2X为二元弱酸,以第一步电离为主,则Ka1(H2X)>Ka2(H2X),酸性条件下,则pH相同时c(HX-)/c(H2X)>c(X2-)/ c(HX-),由图象可知n为lg c(X2-)/ c(HX-)的变化曲线,m为lg c(X2-)/c(HX-)的变化曲线,据此分析解答。
A.由图可知当溶液呈中性时,![]() ,当
,当 ,
,![]() ,因为水解大于电离,所以
,因为水解大于电离,所以![]() ,故A选项错误;
,故A选项错误;
B. 因为![]() 为二元弱酸,
为二元弱酸,![]() ,所以
,所以![]() 的水解程度大,碱性强,故曲线m表示
的水解程度大,碱性强,故曲线m表示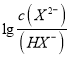 与
与![]() 的变化关系,故B选项正确;
的变化关系,故B选项正确;
C. 当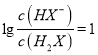 时,
时,![]() ,pH=7.4,
,pH=7.4,![]() ,此时,
,此时,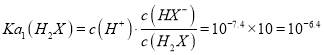 ,
,![]() 的数量级为
的数量级为![]() 是正确的,故C选项正确;
是正确的,故C选项正确;
D.由图可知,![]() 时,当
时,当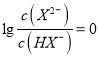 ,即
,即![]() 时,pH>9.3,溶液显碱性,所以水解大于电离,NaHX溶液显碱性,
时,pH>9.3,溶液显碱性,所以水解大于电离,NaHX溶液显碱性,![]() ,故D选项正确;
,故D选项正确;
故答案选A。

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目