题目内容
【题目】下面是某校化学研究性学习小组探究的过量的Fe与浓硫酸反应的实验:
I.甲同学设计如下实验验证反应得到的混合气体中含有SO2、H2、H2O
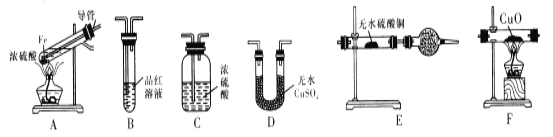
己知:CaSO3受热易分解
(1)写出过量Fe粉与浓硫酸反应产生等体积的SO2与H2的总化学方程式:________
(2)若按气体从左到右的流向,为达到实验目的,各装置连接顺序是A→___(不可重复使用)。
(3)装置E中的干燥管中盛放的物质为碱石灰,其作用是______。
(4)证明有H2存在的实验现象是_________。
II.为测定混合气体中SO2的体积分数,,乙同学设计了如下实验方案:
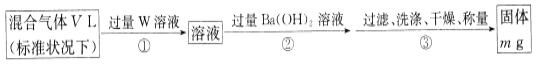
(5)W溶液可以是下列溶液中的______(填字母代号);
A.H2O2溶液 B.NaOH溶液 C.KMnO4溶液(硫酸酸化) D.氯水
该混合气体中二氧化硫的体积分数为___________(用含V、m的代数式表示)。
(6)丙同学使用cmol/LxmLI2的淀粉溶液(过量)吸收混合气体,充分反应后,用0.1000mol/L的Na2S2O3标准溶液去滴定I2的淀粉溶液,达到滴定终点时消耗Na2S2O3的体积为20mL,该混合气体中二氧化硫的体积分数为____ (用含V、c、x的代数式表示)[已知:I2+2S2O32-=2I-+S4O62-]。
【答案】2Fe+3H2SO4=2FeSO4+SO2↑+H2↑+2H2O D→B→C→F→E 防止空气中的水分干扰实验,吸收多余的SO2 F中黑色固体粉末变为红色,E中无水硫酸铜变蓝 AD 22.4m/233V 22.4×10-3(cx-1)/V
【解析】
(1)根据原子守恒可知过量Fe粉与浓硫酸反应产生等体积的SO2与H2的总化学方程式为2Fe+3H2SO4=2FeSO4+SO2↑+H2↑+2H2O。
(2)由于通过溶液会带出水蒸气,首先检验水蒸气,利用品红溶液检验SO2,氢气和氧化铜反应之前还需要干燥氢气,且SO2有毒、还需要防止空气中水蒸气进入,所以若按气体从左到右的流向,为达到实验目的,各装置连接顺序是A→D→B→C→F→E。
(3)反应中产生气体,因此A中导管的作用为安全管,平衡气压;装置E中的干燥管中盛放的物质为碱石灰,其作用是防止空气中的水分干扰实验,吸收多余的SO2。
(4)氢气还原氧化铜生成铜和氢气,则证明有H2存在的实验现象是F中黑色固体粉末变为红色,E中无水硫酸铜变蓝。
(5)由于亚硫酸钡不稳定,因此应该转化为硫酸钡,所以W应该具有氧化性,能把SO2氧化,且不能引入硫酸根,所以选择双氧水或氯水,答案选AD。
硫酸钡是mg,则根据硫原子守恒可知SO2是![]() ,所以该混合气体中二氧化硫的体积分数为
,所以该混合气体中二氧化硫的体积分数为 =
=![]() 。
。
(6)根据方程式I2+SO2+2H2O=H2SO4+2HI、I2+2S2O32-=2I-+S4O62-可知该混合气体中二氧化硫的体积分数为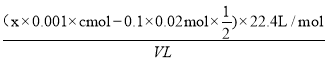 =
=![]() 。
。