题目内容
将0.15mol Fe3O4完全溶解在足量稀硫酸中,然后加入K2Cr2O7溶液250mL,恰好使溶液中Fe2+全部氧化成Fe3+,Cr2O72-全部转化成Cr3+,则K2Cr2O7溶液的物质的量浓度是
| A.0.05mol/L | B.0.1mol/L | C.0.2mol/L | D.0.3mol/L |
B
解析试题分析:由Fe3O4+8H+=Fe2++2Fe3++4H2O可知,n(Fe2+)=n(Fe3O4)=0.15mol;由Fe2+—e—=Fe3+可知,n(e—)失去=n(Fe2+)=0.15mol;设n(K2Cr2O7)=xmol,铬元素由+6价降为+3价,则n(e—)得到=n(K2Cr2O7)×2×3=6xmol;由电子得失相等可知,6x=0.15,则x=0.025mol;由n/V可知c(K2Cr2O7)=0.025mol÷0.25L=0.1mol/L,B项正确。
考点:考查四氧化三铁与硫酸反应、亚铁离子的还原性、重铬酸钾的氧化性、电子守恒原理、物质的量在离子方程式计算中的应用、物质的量浓度等相关知识。

复印机工作时产生臭氧,臭氧的浓度过高时对人体有害。臭氧可使湿润的淀粉碘化钾试
纸变蓝,反应为:2KI+O3+H2O=2KOH+I2+O2,下列结论正确的是( )
| A.O3在反应中被氧化为O2 | B.1molO3在反应中得到6mol电子 |
| C.KI在反应中被还原为I2 | D.KI在反应中被氧化为I2 |
据报道,科学家发现了如下反应:O2+PtF6→O2(PtF6)。已知O2(PtF6)为离子化合物,其中Pt为+5价。对于此反应,下列说法正确的是
| A.此反应是非氧化还原反应 |
| B.O2(PtF6) 中氧元素的化合价是+1价 |
| C.在此反应中,O2是氧化剂,PtF6是还原剂 |
| D.此反应中,每生成1mol O2(PtF6)转移1mol 电子 |
判断一个反应是否为氧化还原反应的标准是
| A.是否有氧参加反应 |
| B.化合物是否分解 |
| C.同一元素的化合价在反应前后是否发生变化 |
| D.是否为化合或分解反应 |
钛被誉为“21世纪金属”。工业冶炼钛的第一步反应为:
TiO2+2C+2Cl2 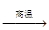 TiCl4+2CO。下列关于该反应的说法正确的是
TiCl4+2CO。下列关于该反应的说法正确的是
| A.TiO2是氧化剂 |
| B.氧化剂与还原剂的物质的量之比为1:1 |
| C.Cl2发生氧化反应 |
| D.当2 mol C参加反应时,转移的电子数目为2 mol |
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O。当产物中n(NO2)∶n(NO)=1∶1时,下列说法正确的是 ( )
| A.产物中n[Cu(NO3)2]∶n[CuSO4]=1∶1 |
| B.参加反应的n(Cu2S)∶n(HNO3)=1∶5 |
| C.反应中Cu2S既作氧化剂,又作还原剂 |
| D.1 mol Cu2S参加反应时有8 mol电子转移 |
在碘酸钠(NaIO3)的碱性溶液中通入Cl2,可以得到高碘酸钠(Na2H3IO6)。下列有关该反应的说法正确的是
| A.该反应中Cl2作还原剂 |
| B.碱性条件下,NaIO3的氧化性强于Na2H3IO6 |
| C.反应中每生成1 mol Na2H3IO6,转移2 mol电子 |
| D.反应中氧化产物与还原产物的物质的量之比为2 : 1 |
 Fe3+的转化,在过程A中,Fe2+被___________,;“服用维生索C可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这一反应过程中做______剂。
Fe3+的转化,在过程A中,Fe2+被___________,;“服用维生索C可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这一反应过程中做______剂。