题目内容
醋酸钡[(CH3COO)2Ba·H2O]是一种媒染剂,下列是有关0.1mol/L醋酸钡溶液中粒子浓度的比较,其中错误的的是
| A.c(Ba2+) >c(CH3COO-)>c(OH-)>c(H+) |
| B.c(H+)+2c(Ba2+)= c(CH3COO-) +c(OH-) |
| C.c(H+) = c(OH-)-c(CH3COOH) |
| D.2c(Ba2+)= c(CH3COO-)+ c(CH3COOH) |
A
解析试题分析:A.(CH3COO)2Ba,因为水解是微弱的,c(CH3COO-) >c(Ba2+)>c(OH-)>c(H+),错误;B.电荷守恒,正确;C.质子守恒,正确;D.物料守恒,正确。
考点:考查溶液中的离子浓度大小比较等相关知识。

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案
相关题目
已知:H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8;H2CO3的Ka1=4.2×10-7,Ka 2=5.6×10-11。现将标准状况下2.24L的CO2和2.24L的SO2分别通入两份150mL1mol/LNaOH溶液中,关于两溶液的比较下列说法正确的是
| A.c(HCO3-)<c(CO32-) |
| B.两溶液都能使酸性高锰酸钾溶液褪色 |
| C.c(HCO3-)>c(HSO3-) |
| D.c(CO32-)+c(HCO3-)=c(SO32-)+c(HSO3-) |
等浓度的NaOH溶液与氢硫酸溶液反应,下列说法不正确的是
| A.溶液中始终有:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| B.溶液呈中性时:c(Na+)=c(HS-)+c(S2-) |
| C.等体积混合后溶液中一定有:c(H2S)+c(H+)=c(S2-)+c(OH-) |
| D.恰好完全中和后的溶液中:c(Na+)>2c(S2-) |
液氨和水类似,也能电离:NH3+NH3 NH4++ NH2-,25℃时,其离子积K=l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中不存在的关系式是(设温度保持不变,溶液体积为1L)
NH4++ NH2-,25℃时,其离子积K=l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中不存在的关系式是(设温度保持不变,溶液体积为1L)
| A.c(Na+) = c(NH2-) | B.c (NH4+)=1×10-29mol/L |
| C.c(NH2-) > c (NH4+) | D.c(NH4+)?c(NH2-) = l.0×l0-30 |
下述实验能达到顶期目的的是
| 编号 | 实验内容 | 实验目的 |
| A | 向1mL0.2mol/LNaOH溶液中滴入2滴0.1mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同条件下,溶解度Mg(OH)2>Fe(OH)3 |
| B | 向混有BaCO3沉淀的NaOH溶液中滴入已知浓度的盐酸(用酚酞作指示剂) | 滴定其中NaOH含量 |
| C | 两种一元碱溶液X和Y(X的pH比Y大l),分别加水稀释l00倍后,pH相等 | 证明稀释前c(X)=10c(Y) |
| D | 测定等物质的量浓度的HF与HCl溶液的pH,后者较小 | 证明非金属性Cl>F |
常温下,取0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合(不计混合后溶液体积变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是
| A.混合溶液中由水电离出来的c(OH-)=1×10-9 mol/L |
| B.混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+) |
| C.c(OH-)=c(HY)=c(H+)=1×10-9 mol/L |
| D.c(Na+)=c(Y-)+c(HY)="0.3" mol/L |
在V mL 0.1 mol/L Na2S溶液中逐滴加入V mL 0. 1 mol/L KHSO4溶液,所得溶液中粒子浓度关系正确的是
| A.c(SO42-)= c(HS-) =c(K+) >c(OH-)=c(H+) |
| B.c(Na+)> c(K+)> c(S2-)> c(H+)>c(OH-) |
| C.c(Na+)= c(S2-)+ c(H2S)+c(HS-)+ c(SO42-) |
| D.c(K+)+ c(Na+)+ c(H+)= c(SO42-)+ c(S2-)+ c(HS-)+ c(OH-) |
现有常温下的四份溶液:① 0.01mol/LCH3COOH;② 0.01mol/LHCl;③ pH=12的氨水;④ pH=12的NaOH溶液。下列说法正确的是
| A.①中水的电离程度最小,②③④中水的电离程度一样大 |
| B.将②③混合,若pH=7,则消耗溶液的体积:②<③ |
| C.将①、④混合,若有c(CH3COO¯)>c(H+),则混合液一定呈碱性 |
| D.将①、④等体积混合,所得溶液中一定有:c(OH¯)=c(H+) + c(CH3COOH) |
下列叙述正确的是
A.已知I3- I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 |
B.室温下向10mL pH =3的醋酸溶液中加水稀释后,溶液中 减小 减小 |
| C.室温时ka(HF)=3.6×10-4,ka(CH3COOH)=1.75×10-5,0.1 mol /L的NaF溶液与0.1 mol /L的CH3COOK溶液相比,一定有c(Na+) -c(F-)<c(K+)-c(CH3COO-)成立 |
D.在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液中c(NH4+)=c(Cl-),则25℃时NH3 ? H2O的电离常数Kb=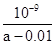 |