题目内容
下列叙述正确的是
A.已知I3- I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 |
B.室温下向10mL pH =3的醋酸溶液中加水稀释后,溶液中 减小 减小 |
| C.室温时ka(HF)=3.6×10-4,ka(CH3COOH)=1.75×10-5,0.1 mol /L的NaF溶液与0.1 mol /L的CH3COOK溶液相比,一定有c(Na+) -c(F-)<c(K+)-c(CH3COO-)成立 |
D.在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液中c(NH4+)=c(Cl-),则25℃时NH3 ? H2O的电离常数Kb=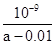 |
D
解析试题分析:A、向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,这说明平衡I3- I2+I-加入适量CCl4后,有利于平衡I3-
I2+I-加入适量CCl4后,有利于平衡I3- I2+I-向右移动,I2溶解在CCl4中显紫红色,A不正确;B、醋酸是弱酸,存在电离平衡,稀释促进电离。由于
I2+I-向右移动,I2溶解在CCl4中显紫红色,A不正确;B、醋酸是弱酸,存在电离平衡,稀释促进电离。由于 =
=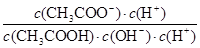 =
= ,因为温度不变,所以
,因为温度不变,所以 不变,B不正确;C、根据HF的电离常数大于醋酸的电离常数,所以醋酸钾的水解程度大于NaF的水解程度,即醋酸钾溶液的碱性强于NaF溶液的碱性。根据电荷守恒可知c(Na+)+c1(H+)=c(F-)+c1(OH-)、c(K+)+c2(H+)=c(CH3COO-) +c2(OH-),则c(Na+) -c(F-)=c1(OH-) -c1(H+)、c(K+)-c(CH3COO-)=c2(OH-) -c2(H+)。因为c1(OH-)<c2(OH-),c1(H+)>c2(H+),所以c(Na+) -c(F-)<c(K+)-c(CH3COO-),C不正确;D、在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液中c(NH4+) =c(Cl-)=0.01 mol/L÷2=0.005mol/L。根据电荷守恒可知c(NH4+) +c(H+)=c(Cl-)+c(OH-),因此c(H+)=c(OH-)=10-7mol/L,而溶液中c(NH3·H2O)=(0.5a-0.005)mol/L,则根据氨水的电离常数表达式可知Kb=
不变,B不正确;C、根据HF的电离常数大于醋酸的电离常数,所以醋酸钾的水解程度大于NaF的水解程度,即醋酸钾溶液的碱性强于NaF溶液的碱性。根据电荷守恒可知c(Na+)+c1(H+)=c(F-)+c1(OH-)、c(K+)+c2(H+)=c(CH3COO-) +c2(OH-),则c(Na+) -c(F-)=c1(OH-) -c1(H+)、c(K+)-c(CH3COO-)=c2(OH-) -c2(H+)。因为c1(OH-)<c2(OH-),c1(H+)>c2(H+),所以c(Na+) -c(F-)<c(K+)-c(CH3COO-),C不正确;D、在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液中c(NH4+) =c(Cl-)=0.01 mol/L÷2=0.005mol/L。根据电荷守恒可知c(NH4+) +c(H+)=c(Cl-)+c(OH-),因此c(H+)=c(OH-)=10-7mol/L,而溶液中c(NH3·H2O)=(0.5a-0.005)mol/L,则根据氨水的电离常数表达式可知Kb=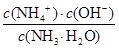 =
= =
=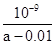 ,D正确。
,D正确。
考点:考查外界条件对平衡状态和电离平衡的影响;盐类水解和溶液中离子浓度大小比较;电离平衡常数的计算等

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案醋酸钡[(CH3COO)2Ba·H2O]是一种媒染剂,下列是有关0.1mol/L醋酸钡溶液中粒子浓度的比较,其中错误的的是
| A.c(Ba2+) >c(CH3COO-)>c(OH-)>c(H+) |
| B.c(H+)+2c(Ba2+)= c(CH3COO-) +c(OH-) |
| C.c(H+) = c(OH-)-c(CH3COOH) |
| D.2c(Ba2+)= c(CH3COO-)+ c(CH3COOH) |
下列说法正确的是
| A.镁与极稀硝酸反应生成硝酸铵的离子方程式为:4Mg+6H++NO3- =4Mg2++NH4++3H2O |
| B.25℃时,将20 mL 0.1mol·L-1H2SO4溶液和30 mL 0.15mol·L-1NaOH溶液混合,若混合后溶液体积不变,则混合溶液的pH为11 |
| C.将10 mL 0.1 mol·L-1KAl(SO4)2溶液和10 mL0.2 mol·L-1Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1:2 |
| D.浓度均为0.1 mol·L-1的醋酸和CH3COONa溶液等体积混合,溶液中有下列关系:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) |
下列有关说法正确的是
| A.Hg(l) + H2SO4(aq) = HgSO4(aq) + H2(g)常温下不能自发进行,说明△H<0 |
| B.用惰性电极电解1L1mol/L的CuSO4溶液,当阴极析出3.2 g铜时,加入0.05 molCu(OH)2固体可将溶液恢复至原浓度 |
| C.已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl的溶解度大于Ag2CrO4的溶解度 |
| D.25℃时,向0.1 mol/L CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 |
常温下体积相同的下列四种溶液:①pH=3的盐酸 ②pH=3的醋酸溶液 ③pH=11的氨水 ④pH=11的NaOH溶液。下列说法中,正确的是
| A.②和④混合,所得混合溶液的pH大于7 |
| B.将四种溶液分别稀释到体积为原的100倍,溶液pH大小顺序③>④>②>① |
| C.③和④分别与足量稀硫酸中和,消耗硫酸的体积③=④ |
| D.①和③混合,所得混合溶液中c(H+)+ c(NH4+)=c(Cl-)+c(OH-) |
下列关于电解质溶液的叙述正确的是
| A.常温下,Na2CO3溶液的pH>7 |
| B.0.1mol/L Na2CO3溶液在35℃时碱性比25℃强,说明该水解反应是是放热反应 |
| C.常温下.pH=7的NH4Cl与氨水的混合溶液中各离子浓度的关系为: c(Cl-)=c(NH4+)>c(H+)=c(OH一) |
| D.常温下,中和pH与体积均相同的盐酸和醋酸,消耗NaOH的物质的量相同 |
常温下,下列有关溶液中微粒的物质的量浓度关系正确的是
| A.pH均为9的①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液,其物质的量浓度的大小顺序为:①>②>③ |
| B.向饱和氯水中加入NaOH溶液至pH=7,所得溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH-) |
| C.0.1 mol·L-1 KHC2O4溶液中:c(OH-)=c(H+) +c(H2C2O4)-2c(C2O42-) |
| D.等物质的量浓度Na2CO3溶液和NaHCO3溶液等体积混合,所得溶液中:c(CO32-)+c(OH-)< c(H+)+c(HCO3-)+3c(H2CO3) |
常温下0.1 mol·L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )
| A.将溶液稀释到原体积的10倍 | B.加入适量的醋酸钠固体 |
| C.加入等体积0.2 mol·L-1盐酸 | D.提高溶液的温度 |
下列关于pH=12的Na2CO3溶液说法正确的是
| A.升高溶液温度,溶液pH增大 |
| B.c(Na+) +c(H+)=c(CO32-)+ c(HCO3-)+ c(OH-) |
| C.溶液中c(OH-)>c(HCO3-)> c(H+) |
| D.2c(Na+)=c(CO32-)+ c(HCO3-)+ c(H2CO3) |