��Ŀ����
����Ŀ�������£���0.01molNH4Cl��0.005molNaOH����ˮ���1L��Һ(pH>7).
��1������Һ�д��ڵ�����ƽ����ϵ�� �� �� ��
��2����Һ�д��ڵ��������ʵ���Ũ���ɴ�С˳��Ϊ ��
��3����Щ������Ũ��Ϊ0.01mol/L���� ��Ũ��Ϊ0.005mol/L���� ��
��4�����ʵ���֮��Ϊ0.0lmol�Ķ��������� ��
��5��NH4+��H+�����������ʵ���֮�ͱ�OH-�� mol��
���𰸡���1��NH3H2O![]() NH4++OH-(2��)
NH4++OH-(2��)
NH4++H2O![]() NH3��H2O+H+(2��)
NH3��H2O+H+(2��)
H2O![]() H++OH-(2��)
H++OH-(2��)
��2��c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)(2��)
��3��Cl-(l��)Na+(1��)
��4��NH4+��NH3��H2O(ȫѡ��2����ѡ��0��)
��5��0.005(2��)
��������
��������������½�0.01mol NH4Cl��0.002mol NaOH����ˮ���1L��Һ����Һ�д���0.002molNaCl��0.002molNH3H2O��0.008mol NH4Cl��
��1������Һ�д��ڵ�����ƽ����ϵ��笠����ӵ�ˮ��ƽ��NH4++H2O![]() NH3H2O+H+��笠����Ӻ����������ӷ�����Ӧ�Ļ�ѧƽ��NH4++OH-
NH3H2O+H+��笠����Ӻ����������ӷ�����Ӧ�Ļ�ѧƽ��NH4++OH-![]() NH3H2O��������ʵĵ���ƽ�� H2O
NH3H2O��������ʵĵ���ƽ�� H2O![]() H++OH-��
H++OH-��
��2����0.01molNH4Cl��0.005molNaOH����ˮ��Ӧ��õ�0.005molNaCl��0.005molNH3H2O��0.005molNH4Cl����NH3H2O�������ˮ��NH4+������Һ�����������Ĵ�С��ϵΪ c (Cl-) >c (NH4+)>c (Na+) >c (OH-) >c(H+) ��
��3����Щ���������ӡ����������ʵ������䣬����Ũ��Ϊ0.01mol/L����Cl-��Ũ��Ϊ0.005mol/L����Na+��
��4�������غ���������ʵ���֮��Ϊ0.01mol����������NH4+��NH3H2O��
��5����Һ�д��ڵ���غ㣬c(H+)+c(Na+)+c(NH4+)=c(Cl-)+c(OH-)��c(Na+)=0.005mol/L��c(Cl-)=0.01mol/L���õ�c(H+)+c(NH4+)-c(OH-)=c(Cl-)-c(Na+)=0.005mol/L����Һ���Ϊ1L���� NH4+��H+�����������ʵ���֮�ͱ�OH-��0.005mol��

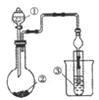
����Ŀ������ͼʾװ�ý���ʵ�飬���ܵó���Ӧ���۵��ǣ� ��
��Һ�� | ����� | ��Һ�� | ʵ����� |
| |
A | ϡ���� | Na2CO3 | Na2SiO3 | �ǽ����ԣ�S>C>Si | |
B | Ũ���� | KMnO4 | Na2S | �����ԣ�KMnO4>Cl2>S | |
C | ŨH2SO4 | Cu | ������ | ��Һ����� | |
D | Ũ��ˮ | CaO | AlCl3 | �����Ʊ�Al(OH)3 |
A. A B. B C. C D. D