题目内容
【题目】1.
纳米级Cu2O由于具有优良的催化性能而备受关注,下表为制取纳米级Cu2O的三种方法:
窗体顶端
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 电解法,反应为2Cu+H2O |
方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成________而使Cu2O产率降低。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =_____。
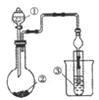
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,电解装置如下图所示。

①阴极上的产物是________ 。
②阳极生成Cu2O,其电极反应式为_________。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该反应的化学方程式为____________。
(5)肼又称联氨,易溶于水,是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因______。
(6)向1L恒容密闭容器中充入0.1molN2H4,在30℃、Ni-Pt催化剂作用下发生反应N2H4(g)![]() N2(g)+2H2(g),测得混合物体系中,
N2(g)+2H2(g),测得混合物体系中,![]() (用y表示)与时间的关系如图所示。0-4min时间内H2的平均生成速率v(H2)=____mol/(L·min);该温度下,反应的平衡常数=_______。
(用y表示)与时间的关系如图所示。0-4min时间内H2的平均生成速率v(H2)=____mol/(L·min);该温度下,反应的平衡常数=_______。

(7)肼-空气清洁燃料电池是一种碱性燃料电池,电解质溶液时20%-30%的KOH溶液。肼-空气燃料电池放电时,负极的电极反应式是_________。电池工作一点时间后,电解质溶液的pH将_______(填“增大”、“减小”、“不变”)。
【答案】 Cu -(a+b-2c)kJ/mol(写成+(a-b+2c)kJ/mol也可) H2 2Cu-2e-+2OH-=Cu2O+H2O 4Cu(OH)2+ N2H4![]() 2Cu2O + N2↑ + 6H2O N2H4+H2O
2Cu2O + N2↑ + 6H2O N2H4+H2O![]() N2H5++OH- 0.025 0.01 N2H4-4e-+4OH-=N2+4H2O 减小
N2H5++OH- 0.025 0.01 N2H4-4e-+4OH-=N2+4H2O 减小
【解析】(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当氧化铜被还原为铜而使Cu2O产率降低;(2)已知:①2Cu(s)+1/2O2(g)=Cu2O(s) △H =-akJ·mol-1,②C(s)+1/2O2(g)=CO(g) △H =-bkJ·mol-1,③Cu(s)+1/2O2(g)=CuO(s) △H =-ckJ·mol-1,则根据盖斯定律可知①+②-③×2即得到反应2CuO(s)+C(s)= Cu2O(s)+CO(g)△H =-(a+b-2c)kJ/mol;(3)①阴极上是氢离子放电产生氢气,则阴极的产物是氢气。②在电解池中,当阳极是活泼电极时,该电极本身发生失电子的还原反应,在碱性环境下,金属铜失去电子的电极反应为2Cu-2e-+2OH-=Cu2O+H2O;(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,根据电子得失守恒和原子守恒可知该反应的化学方程式为4Cu(OH)2+ N2H4![]() 2Cu2O + N2↑ + 6H2O;(5)根据一水合氨的电离方程式可知肼的电离方程式为N2H4+H2O
2Cu2O + N2↑ + 6H2O;(5)根据一水合氨的电离方程式可知肼的电离方程式为N2H4+H2O![]() N2H5++OH-;(6)设平衡时n(N2)=a,n(H2)=2a,n(N2H4)=0.1 mol-a,则:3a=3.0×(0.1 mol-a),a=0.05 mol,υ(H2)=0.05mol×2/(1L×4min)=0.025mol/(Lmin),K=c(N2)×c2(H2)/c(N2H4)=0.05×(0.05×2)2/(0.10.05)=0.01;(7)原电池中负极发生失去电子的氧化反应,则肼-空气清洁燃料电池肼在负极通入,溶液显碱性,则负极的电极反应式是N2H4-4e-+4OH-=N2+4H2O;正极氧气得到电子,电极反应式为O2+4e-+2H2O=4OH-,反应后生成水和氮气,则电池工作一点时间后,电解质溶液的pH将减小。
N2H5++OH-;(6)设平衡时n(N2)=a,n(H2)=2a,n(N2H4)=0.1 mol-a,则:3a=3.0×(0.1 mol-a),a=0.05 mol,υ(H2)=0.05mol×2/(1L×4min)=0.025mol/(Lmin),K=c(N2)×c2(H2)/c(N2H4)=0.05×(0.05×2)2/(0.10.05)=0.01;(7)原电池中负极发生失去电子的氧化反应,则肼-空气清洁燃料电池肼在负极通入,溶液显碱性,则负极的电极反应式是N2H4-4e-+4OH-=N2+4H2O;正极氧气得到电子,电极反应式为O2+4e-+2H2O=4OH-,反应后生成水和氮气,则电池工作一点时间后,电解质溶液的pH将减小。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】利用图示装置进行实验,不能得出相应结论的是( )
溶液① | 固体② | 溶液③ | 实验结论 |
| |
A | 稀硫酸 | Na2CO3 | Na2SiO3 | 非金属性:S>C>Si | |
B | 浓盐酸 | KMnO4 | Na2S | 氧化性:KMnO4>Cl2>S | |
C | 浓H2SO4 | Cu | 氢硫酸 | 溶液变浑浊 | |
D | 浓氨水 | CaO | AlCl3 | 可以制备Al(OH)3 |
A. A B. B C. C D. D