题目内容
【题目】在标准状况下充满HCl的烧瓶做完喷泉实验后得到稀盐酸,用标准碳酸钠溶液滴定这种盐酸测定它的准确浓度,请你回答下列问题:
(1)用标准Na2CO3溶液滴定这种盐酸时,Na2CO3溶液应装在_______式滴定管内,原因是(文字叙述并用有关离子方程式表示): ;若用甲基橙作指示剂,达到滴定终点时,溶液从_______色变为_______色。
(2)现配制三种浓度的标准Na2CO3溶液,你认为最合适的是下列第______种(填序号)。
①2.500 mol/L ②0.25 mol/L ③0.025mol/L
(3)若采用上述合适浓度的标准Na2CO3溶液滴定,用C(Na2CO3)表示,滴定时实验数据列表如下:
实验编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
1 | 20.00 | 18.80 |
2 | 20.00 | 16.95 |
3 | 20.00 | 17.05 |
根据以上数据计算时应带入的Na2CO3溶液体积为_________,求这种待测盐酸的物质的量浓度(用数据和符号列式即可):C(HCl)=_________ 。
(4)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,则最后所测盐酸浓度______(填“偏高”、“偏低”或“无影响”)。
【答案】(1) 碱式;CO3- + H2O ![]() HCO3- +OH- 红色;橙色;(2)③
HCO3- +OH- 红色;橙色;(2)③
(3)![]()
![]()
(4)偏高
【解析】
试题分析:(1)碳酸钠溶液因发生水解呈碱性,用碱式滴定管盛装碳酸钠溶液,水解反应式为CO3- + H2O ![]() HCO3- +OH-;滴定终点时,溶液颜色由红色变为橙色且半分钟内不变色;
HCO3- +OH-;滴定终点时,溶液颜色由红色变为橙色且半分钟内不变色;
(2)HCl的大致浓度为1/22.4mol/L=0.045mol/L,标准碳酸钠溶液应选0.025mol/L,故选③;
(3)舍去第一组数据,碳酸钠溶液的平均体积为![]() mL,
mL,
2HCl~Na2CO3
2 1
C(HCl)×20.00mL 0.025mol/L×![]() mL
mL
C(HCl)=![]() ;
;
(4)盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,标准液的浓度降低,造成V(标准液)偏大,根据c(待测)=![]() 可知c(待测)偏高。
可知c(待测)偏高。

 轻松夺冠全能掌控卷系列答案
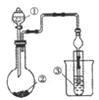
轻松夺冠全能掌控卷系列答案【题目】利用图示装置进行实验,不能得出相应结论的是( )
溶液① | 固体② | 溶液③ | 实验结论 |
| |
A | 稀硫酸 | Na2CO3 | Na2SiO3 | 非金属性:S>C>Si | |
B | 浓盐酸 | KMnO4 | Na2S | 氧化性:KMnO4>Cl2>S | |
C | 浓H2SO4 | Cu | 氢硫酸 | 溶液变浑浊 | |
D | 浓氨水 | CaO | AlCl3 | 可以制备Al(OH)3 |
A. A B. B C. C D. D