题目内容
已知热化学方程式:C2H2(g)+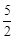 O2(g)=2CO2(g)+H2O(g)
O2(g)=2CO2(g)+H2O(g) 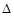 H=-1256 kJ·mol-1。下列说法正确的是( )
H=-1256 kJ·mol-1。下列说法正确的是( )
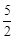 O2(g)=2CO2(g)+H2O(g)
O2(g)=2CO2(g)+H2O(g) 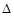 H=-1256 kJ·mol-1。下列说法正确的是( )
H=-1256 kJ·mol-1。下列说法正确的是( )| A.C2H2的燃烧热为1256kJ/mol |
B.若生成2mol液态水,则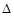 H=-2512kJ/mol H=-2512kJ/mol |
| C.若转移10mol电子,则消耗2.5mol O2 |
| D.若形成4mol碳氧共用电子对,则放出的热量为2512kJ |
C
燃烧热是指在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,水的稳定状态是液态。A不正确。气态水生成液态是放出热量,B不正确。1mol氧气得到4mol电子,所以转移10mol电子,需要2.5mol氧气,C正确。形成4mol碳氧共用电子对,则生成2molCO2,放出的热量为1256kJ,所以D不正确,答案选C。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目

 的绝对值均正确)( )
的绝对值均正确)( ) ①煅烧石灰石 ②氨水和醋酸混合 ③液化石油气燃烧
①煅烧石灰石 ②氨水和醋酸混合 ③液化石油气燃烧