题目内容
(6分)(1)下列反应断裂旧化学键需要的能量比形成新化学键放出的能量多的有____
 ①煅烧石灰石 ②氨水和醋酸混合 ③液化石油气燃烧
①煅烧石灰石 ②氨水和醋酸混合 ③液化石油气燃烧
④Ba(OH)2?8H2O固体和氯化铵固体充分混合 ⑤在家中用铁钉和醋酸制取少许氢气
⑥人体内的呼吸作用 ⑦绿色植物的光合作用
(2)①甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水,已知室温下1g甲硅烷自燃放出热量44.6kJ,其热化学方程式是______________________
②已知H2O(g)=H2O (l) DH2=–44 kJ·mol-1,则16g甲硅烷完全燃烧生成水蒸气时放热_________KJ。
 ①煅烧石灰石 ②氨水和醋酸混合 ③液化石油气燃烧
①煅烧石灰石 ②氨水和醋酸混合 ③液化石油气燃烧④Ba(OH)2?8H2O固体和氯化铵固体充分混合 ⑤在家中用铁钉和醋酸制取少许氢气
⑥人体内的呼吸作用 ⑦绿色植物的光合作用
(2)①甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水,已知室温下1g甲硅烷自燃放出热量44.6kJ,其热化学方程式是______________________
②已知H2O(g)=H2O (l) DH2=–44 kJ·mol-1,则16g甲硅烷完全燃烧生成水蒸气时放热_________KJ。
(1)①④⑦
(2)① SiH4(g)+2O2(g)==SiO2(s)+2H2O(1) △H==-1427.2kJ/mol ②669.6
(2)① SiH4(g)+2O2(g)==SiO2(s)+2H2O(1) △H==-1427.2kJ/mol ②669.6
(1)断裂旧化学键需要的能量比形成新化学键放出的能量多,说明是吸热反应,所以正确的答案是①④⑦。
(2)①1g甲硅烷自燃放出热量44.6kJ,则1mol放出的热量是44.6kJ×32=1427.2kJ,所以热化学方程式为SiH4(g)+2O2(g)==SiO2(s)+2H2O(1) △H==-1427.2kJ/mol。
②根据H2O(g)=H2O (l) DH2=–44 kJ·mol-1可知,甲硅烷完全燃烧生成水蒸气时的热化学方程式为SiH4(g)+2O2(g)==SiO2(s)+2H2O(1) △H==-1339.2kJ/mol,所以16g甲硅烷完全燃烧生成水蒸气时放热是1339.2kJ/mol×0.5mol=669.6kJ。
(2)①1g甲硅烷自燃放出热量44.6kJ,则1mol放出的热量是44.6kJ×32=1427.2kJ,所以热化学方程式为SiH4(g)+2O2(g)==SiO2(s)+2H2O(1) △H==-1427.2kJ/mol。
②根据H2O(g)=H2O (l) DH2=–44 kJ·mol-1可知,甲硅烷完全燃烧生成水蒸气时的热化学方程式为SiH4(g)+2O2(g)==SiO2(s)+2H2O(1) △H==-1339.2kJ/mol,所以16g甲硅烷完全燃烧生成水蒸气时放热是1339.2kJ/mol×0.5mol=669.6kJ。

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
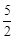 O2(g)=2CO2(g)+H2O(g)
O2(g)=2CO2(g)+H2O(g) 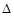 H=-1256 kJ·mol-1。下列说法正确的是( )
H=-1256 kJ·mol-1。下列说法正确的是( ) ·8H
·8H