题目内容
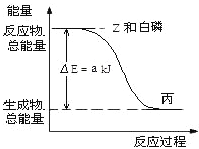
【题目】已知:①CH3OH(g) +3/2O2(g)=CO2(g)+2H2O(g) △H=-akJ·mol一1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-bkJ·mol一1
③CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H=-ckJ·mol一1
则下列叙述正确的是( )
A. 由上述热化学方程式可知b>c
B. 甲烷的燃烧热为bkJ/mol
C. 2CH3OH(g)=2CH4(g) +O2(g) △H=2(b一a)KJ mol一1
D. 当甲醇和甲烷物质的量之比为1:2时,其完全燃烧生成CO2和H2O(1)时,放出的热量为Q kJ,则该混合物中甲醇的物质的量为Q/(a+2b) mol
【答案】C
【解析】试题分析:A、气态水到液态水继续放热,所以b<c,故A错误;B、燃烧热应生成稳定氧化物,不能使水蒸气,应该是液态水,故B错误;C、根据盖斯定律,将两个反应都乘以2,再相减,得到:2CH3OH(g)=2CH4(g)+O2(g)△H=2(a-b) kJmol-1,故C正确;D、设甲醇和甲烷物质的量分别为n、2n,则甲醇放出的热量是na,甲烷放出的热量是2nc,即na+2nc=Q,解得n=![]() mol,则该混合物中甲醇的物质的量为
mol,则该混合物中甲醇的物质的量为![]() ,故D错误;故选C。
,故D错误;故选C。

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目