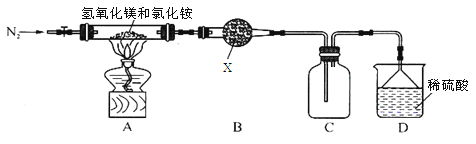
题目内容
【题目】中国自古有“信口雌黄”、“雄黄入药”之说。雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。根据题意完成下列填空:
(1) 砷元素有+2、+3两种常见价态。As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体,写出该反应的化学方程式_____________________。
(2) 上述反应中的氧化剂是___________;氧化产物是___________;反应产生的H2S气体可用____________吸收。
(3)As2S3和HNO3有如下反应:As2S3+10H++ 10NO3—=2H3AsO4+3S+10NO2↑+ 2H2O。若生成1mol H3AsO4,则反应中转移电子的物质的量为___________;若将该反应设计成一原电池,则NO2应该在___________(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2LO2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,写出碳与浓硝酸反应的化学方程式__________________;所产生的CO2的量___________(选填编号)。
A.小于0.5mol B.等于0.5mol C.大于0.5mol D.无法确定
【答案】(1)2As2S3+2SnCl2+4HCl==As4S4+2SnCl4+2H2S↑(2分)
(2)As2S3(1分);SnCl4(1分);NaOH溶液或CuSO4溶液(1分)(3)5mol(1分);正极(1分)
(4)C+4HNO3(浓![]() CO2↑+4NO2↑+2H2O(2分);A(1分)
CO2↑+4NO2↑+2H2O(2分);A(1分)
【解析】
试题分析:(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体,反应的方程式为2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑;
(2)因在该反应中As2S3中As元素的化合价降低,则As2S3为氧化剂;SnCl2是还原剂,则SnCl4是氧化产物;H2S为酸性气体,可用NaOH溶液吸收,硫化铜不溶于酸,也可以硫酸铜溶液吸收;
(3)反应As2S3+10H++ 10NO3—=2H3AsO4+3S+10NO2↑+ 2H2O中,As元素化合价由+3价升高到+5价,S元素化合价由-2价升高到0价,若生成1mol H3AsO4,转移电子数为1mol×(5-3)+3mol×(0+2)=5mol;N元素化合价由+5降低为+4,反应中NO3-发生还原反应生成NO2,则NO2在正极析出;
(4)碳与浓硝酸反应的化学方程式为C+4HNO3(浓![]() CO2↑+4NO2↑+2H2O;由NO2与11.2LO2混合后用水吸收全部转化成浓HNO3,浓硝酸与碳反应生成二氧化碳与二氧化氮,若反应得到硝酸能与碳完全反应,纵观整个过程,氧气获得电子等于碳失去电子,氧气的物质的量为11.2L÷22.4L/mol=0.5mol,根据电子转移守恒,反应碳的物质的量为0.5mol×4/4=0.5mol,但随着反应到进行,硝酸的浓度会降低,而稀硝酸不与碳反应,则产生的CO2的量小于0.5mol,答案选A。
CO2↑+4NO2↑+2H2O;由NO2与11.2LO2混合后用水吸收全部转化成浓HNO3,浓硝酸与碳反应生成二氧化碳与二氧化氮,若反应得到硝酸能与碳完全反应,纵观整个过程,氧气获得电子等于碳失去电子,氧气的物质的量为11.2L÷22.4L/mol=0.5mol,根据电子转移守恒,反应碳的物质的量为0.5mol×4/4=0.5mol,但随着反应到进行,硝酸的浓度会降低,而稀硝酸不与碳反应,则产生的CO2的量小于0.5mol,答案选A。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案【题目】

(1)该硫酸的物质的量浓度是________mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要490 mL 4.6 mol/L的稀硫酸,则需要取________mL的该硫酸。
(3)配制时,所需的玻璃仪器除量筒、烧杯、玻璃棒和胶头滴管之外,还需要 (填仪器名称);
(4)配制溶液有如下(未按顺序排列):a.溶解,b.摇匀,c.洗涤,d.冷却,e.称量,f.将溶液移至容量瓶,g.定容等操作。其中摇匀的前一步操作是 ;(填写字母)
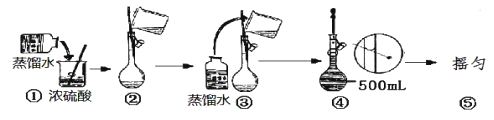
(5)在下列配制过程示意图中,有错误的是(填写序号) 。
(6)在配制4.6 mol/L的稀硫酸的过程中,下列情况会引起硫酸溶液物质的量浓度偏高的是
A.未经冷却趁热将溶液注入容量瓶中 | B.容量瓶洗涤后,未经干燥处理 |
C.定容时仰视观察液面 | D.未洗涤烧杯和玻璃棒 |