题目内容
【题目】X、Y、Z 为不同短周期非金属元素的气态单质。在一定条件下能发生如下反应:
Y+X→甲(g),Y+Z→乙(g)。甲为10电子分子,Z为黄绿色气体。甲、乙可化合生成离子化合物。
(1)X 的电子式是______________。
(2)写出Y+X→甲(g)的化学方程式_____________________。
(3)向一定浓度的 BaCl2溶液中通入 SO2气体,未见沉淀生成,若在通入 SO2气体的同时加入或通入某纯净物(从X、Y、Z、甲、乙中选择),即可生成白色沉淀,该纯净物的化学式为________,生成的白色沉淀的化学式为___________。
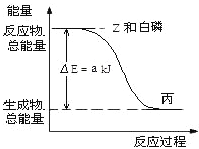
(4)已知常温下,PCl3为液体,PCl5为固体。白磷(P4)在Z气体中燃烧生成液态丙分子,白磷固体和 Z 气体反应,生成1 mol液态丙时,能量变化如图所示,写出该反应的热化学方程式_______________。
已知1 mol白磷固体和Z气体反应,生成固态丁时,放热b kJ,则1 mol固态丁转化为液态丙时的反应热ΔH=_____________。
【答案】(1)![]() (2)N2+3H2
(2)N2+3H2![]() 2NH3
2NH3
(3)Cl2或NH3,BaSO4或BaSO3
(4)1/4P4(s)+3/2Cl2(g)=PCl3(l) ΔH=–a kJ/mol;(a–b/4) kJ/mol
【解析】试题分析:X、Y、Z为不同短周期非金属元素的气态单质,Y+X→甲(g),Y+Z→乙(g),甲为10电子分子,Z为黄绿色气体,甲、乙可化合生成离子化合物,则该化合物为NH4Cl,则甲为NH3,乙为HCl,Y为H2,X为N2,Z为Cl2。
(1)X为N2,氮原子之间有3对共用电子对,电子式为![]() ;
;
(2)Y+X→甲(g)的化学方程式为N2+3H2![]() 2NH3。
2NH3。
(3)若在通入SO2气体的同时加入Cl2,发生反应为SO2+Cl2+2H20═H2SO4+2HCl,在BaCl2溶液中生成BaSO4沉淀,若在通入SO2气体的同时加入NH3,溶液中存在大量的SO32-,可生成白色沉淀BaSO3,该纯净物可能是Cl2、NH3。
(4)根据图像可知白磷和氯气的总能量大于PCl3的能量,该反应为放热反应,所以热化学方程式为1/4P4(s)+3/2Cl2(g)=PCl3(l) ΔH=–a kJ/mol;1 mol白磷固体和氯气反应,生成PCl5固体时,放热 b kJ,热化学方程式为1/4P4(s)+5/2Cl2(g)=PCl5(s) △H=-b/4kJ/mol,根据盖斯定律,1 mol固态PCl5转化为液态PCl3时的反应热△H=(a–b/4)kJ/mol。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】

(1)该硫酸的物质的量浓度是________mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要490 mL 4.6 mol/L的稀硫酸,则需要取________mL的该硫酸。
(3)配制时,所需的玻璃仪器除量筒、烧杯、玻璃棒和胶头滴管之外,还需要 (填仪器名称);
(4)配制溶液有如下(未按顺序排列):a.溶解,b.摇匀,c.洗涤,d.冷却,e.称量,f.将溶液移至容量瓶,g.定容等操作。其中摇匀的前一步操作是 ;(填写字母)
(5)在下列配制过程示意图中,有错误的是(填写序号) 。
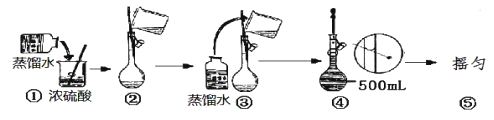
(6)在配制4.6 mol/L的稀硫酸的过程中,下列情况会引起硫酸溶液物质的量浓度偏高的是
A.未经冷却趁热将溶液注入容量瓶中 | B.容量瓶洗涤后,未经干燥处理 |
C.定容时仰视观察液面 | D.未洗涤烧杯和玻璃棒 |
【题目】分部分中学化学常见元素原子结构及性质如表所示:
序号 | 元素 | 结构及性质 |
① | A | A是一种常见金属,它的一种氧化物是具有磁性的黑色晶体 |
② | B | B是一种常见金属,原子核外有三个电子层且最外层电子为偶数 |
③ | C | C的气态氢化物易液化常作制冷剂 |
④ | D | D为灰黑色具有金属光泽的固体,是太阳能电池板的常用材料 |
⑤ | E | E原子最外层电子数是内层电子总数的3倍 |
⑥ | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
(1)A原子在周期表中的位置为______________,离子半径:B2+_________C3-(填"大于、小于或等于”)。
(2)简单气态氢化物的热稳定性:D__________E(填"大于、小于或等于”)。
(3)①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,区别X与Y的水溶液的实验方法是________________。
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的电子式为__________,N的结构式为___________。
(4)用化学方程式表明C与E这两种元素的非金属性的强弱_________________。
【题目】某校化学兴趣小组同学取锌粒与浓H2SO4充分反应制取SO2气体,待锌粒全部溶解后,同学们准备用收集到的气体(X)准备做实验,但是老师说收集到的气体(X)可能含有杂质。
(1)该化学兴趣小组制得的气体(X)中混有的主要杂质气体可能是________(填化学式),写出此过程所发生的2个化学反应方程式:_______________________; ______________________。
(2)一定质量的Zn与87.5mL 16.0mol/L浓硫酸充分反应,反应后称量剩余锌发现质量减少了78g,产生SO2体积(标准状况下)= _____________L。
(3)为证实相关分析,该小组的同学设计了如下图所示的实验装置,对此气体(X)取样进行认真研究(遇有气体吸收过程,可视为全吸收)。
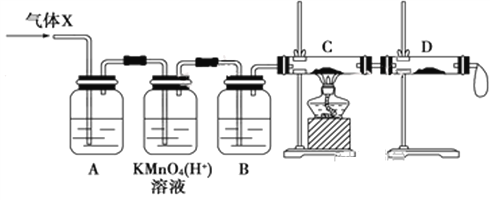
①酸性KMnO4溶液的作用是__________________;B中添加的试剂是_____________。
②装置C中所装药品为________________,可证实气体X中混有较多量某杂质气体的实验现象是_______________________________________。
(4)实验室中某些气体的制取、收集及尾气处理装置如下图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是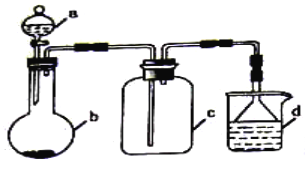 (_____)
(_____)
选项 | a物质 | b物质 | c收集的气体 | d中的物质 |
A | 浓氨水 | NaOH | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | 澄清石灰水 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |