题目内容
4.在实验室可以用图所示的装置制取乙酸乙酯,下列说法不正确的是( )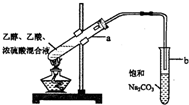
| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加入乙酸 | |
| B. | 饱和碳酸钠溶液可以除去乙酸乙酯中混有的乙酸 | |
| C. | 向a试管中加入几块碎瓷片的作用是防止加热时液体暴沸 | |
| D. | 将制得的乙酸乙酯分离出来,应采用“分液”的实验操作 |
分析 A.从浓硫酸溶于水放热分析,加入药品时,为防止酸液飞溅,应先加入乙醇再加入浓硫酸和乙酸;
B.乙酸的酸性强于碳酸,用饱和碳酸钠溶液可以除去乙酸乙酯中混有的乙酸;
C.乙酸、乙醇沸点低,加热要加碎瓷片,防止暴沸;
D.乙酸乙酯密度比水小,乙酸乙酯在上层,分离互不相溶的液体通常用分液的方法.
解答 解:A.浓硫酸溶于水放出大量的热,乙醇中含有少量水,防止硫酸溶解时放出大量的热导致液体飞溅,应先加入乙醇再加入浓硫酸和乙酸,故A错误;
B.因乙酸的酸性比碳酸强,所以乙酸能和碳酸钠反应生成二氧化碳气体,2CH3COOH+CO32-→2CH3COO-+H2O+CO2↑,故B正确;
C.乙酸、乙醇沸点低,液体加热要加碎瓷片,引入汽化中心,可防止溶液暴沸,故C正确;
D.试管b中液体混合物分层不互溶,乙酸乙酯在上层,可用分液方法分离,故D正确;
故选A.
点评 本题考查乙酸乙酯的制备以及对操作与反应装置理解,题目难度不大,注意制取乙酸乙酯加入试剂时应考虑浓硫酸的稀释问题以及乙酸乙酯的制备原理.

练习册系列答案
相关题目
14.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
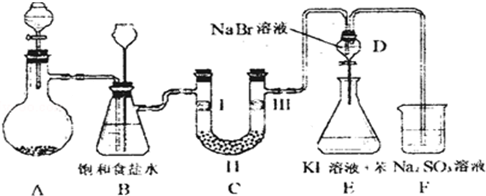
(1)制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入d.
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为黄色,说明氯的非金属性大于溴.
(5)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层)为紫红色.
(6)有人提出,装置F中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:SO32-+Cl2+H2O=SO42-+2Cl-+2H+,判断改用NaHSO3溶液是否可行否(填“是”或“否”).

(1)制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入d.
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层)为紫红色.
(6)有人提出,装置F中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:SO32-+Cl2+H2O=SO42-+2Cl-+2H+,判断改用NaHSO3溶液是否可行否(填“是”或“否”).
15.合成氨的反应进行到2秒时,氨气的浓度增加了0.6mol/L.用氮气的浓度变化表示该时间段的反应速率为( )
| A. | 0.15 mol/(L•S) | B. | 0.3 mol/(L•S) | C. | 0.6 mol/(L•S) | D. | 0.9 mol/(L•S) |
12.下列每一序号代表一种元素.元素①是常见的过渡元素,其氧化物呈黑色且只有磁性.元素②-⑤性质如表1和元素⑥-⑩在周期表中的位置如表2所示,请回答下列有关问题:
表1
表2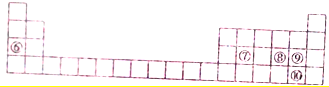
(1)元素⑩的名称是溴;元素⑤的简单离子的结构示意图是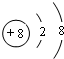 ;所给元素中,其含氧化合物能用于漂白,该元素可能是S、Cl(填元素符号)
;所给元素中,其含氧化合物能用于漂白,该元素可能是S、Cl(填元素符号)
(2)元素④在周期表中的位置是第二周期VA族,该元素的氢化物与元素⑤的单质在高温催化剂条件下反应的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O
(3)元素②、③、⑥的离子的氧化性由强到弱的顺序为Al3+>Mg2+>Na+(填离子符号);元素③的单质与元素①的磁性氧化物咋高温条件下发生反应的化学方程式为3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Al+4Al2O3
(4)元素⑥的焰色反应为黄色,该元素的单质在元素⑤的单质中燃烧的产物含量的化学键为离子键、共价键
(5)元素⑦、⑧、⑨的氢化物的稳定性由弱到强的顺序为SiH4<H2S<HCl(填化学式),设计实验证明单质氧化性顺序为⑩>⑧取少量硫化钠溶液于试管中,滴加溴水,试管中出现淡黄色沉淀,证明Br2的氧化性比S的强.
表1
| 元素符号 | ② | ③ | ④ | ⑤ |
| 原子半径 | 130 | 118 | 75 | 73 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |

(1)元素⑩的名称是溴;元素⑤的简单离子的结构示意图是
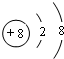 ;所给元素中,其含氧化合物能用于漂白,该元素可能是S、Cl(填元素符号)
;所给元素中,其含氧化合物能用于漂白,该元素可能是S、Cl(填元素符号)(2)元素④在周期表中的位置是第二周期VA族,该元素的氢化物与元素⑤的单质在高温催化剂条件下反应的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O
(3)元素②、③、⑥的离子的氧化性由强到弱的顺序为Al3+>Mg2+>Na+(填离子符号);元素③的单质与元素①的磁性氧化物咋高温条件下发生反应的化学方程式为3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Al+4Al2O3
(4)元素⑥的焰色反应为黄色,该元素的单质在元素⑤的单质中燃烧的产物含量的化学键为离子键、共价键
(5)元素⑦、⑧、⑨的氢化物的稳定性由弱到强的顺序为SiH4<H2S<HCl(填化学式),设计实验证明单质氧化性顺序为⑩>⑧取少量硫化钠溶液于试管中,滴加溴水,试管中出现淡黄色沉淀,证明Br2的氧化性比S的强.
19.下列物质性质的变化规律,与共价键能大小有关的是( )
| A. | F2、Cl2、Br2、I2的熔点、沸点逐渐升高 | |
| B. | Li、Na、K、Rb熔沸点依次减弱 | |
| C. | 金刚石的硬度、熔点、沸点都高于晶体硅 | |
| D. | NaF、NaCl、NaBr、NaI的熔点依次降低 |
9.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 11.2 L氧气中所含有的原子数为NA | |
| B. | 标准状况下,22.4LCCl4所含分子数为NA | |
| C. | 7.8g的Na2O2中含有的阴离子的数目为0.2NA | |
| D. | 27g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是3NA |
13.下列现象不能用有机物鉴别的是( )
| A. | 遇碘单质是否变蓝-淀粉和纤维素 | |
| B. | 遇浓硝酸是否变黄-某些蛋白质和油脂 | |
| C. | 与氯气混合后光照,气体颜色是否逐渐变浅-甲烷和乙烷 | |
| D. | 与新制的氢氧化铜共热是否产生砖红色沉淀-葡萄糖和蔗糖 |
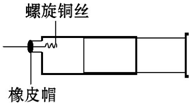 某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO.实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生.
某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO.实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生.