题目内容
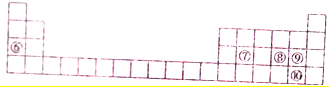
12.下列每一序号代表一种元素.元素①是常见的过渡元素,其氧化物呈黑色且只有磁性.元素②-⑤性质如表1和元素⑥-⑩在周期表中的位置如表2所示,请回答下列有关问题:表1
| 元素符号 | ② | ③ | ④ | ⑤ |
| 原子半径 | 130 | 118 | 75 | 73 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
(1)元素⑩的名称是溴;元素⑤的简单离子的结构示意图是
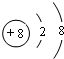 ;所给元素中,其含氧化合物能用于漂白,该元素可能是S、Cl(填元素符号)
;所给元素中,其含氧化合物能用于漂白,该元素可能是S、Cl(填元素符号)(2)元素④在周期表中的位置是第二周期VA族,该元素的氢化物与元素⑤的单质在高温催化剂条件下反应的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O
(3)元素②、③、⑥的离子的氧化性由强到弱的顺序为Al3+>Mg2+>Na+(填离子符号);元素③的单质与元素①的磁性氧化物咋高温条件下发生反应的化学方程式为3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Al+4Al2O3
(4)元素⑥的焰色反应为黄色,该元素的单质在元素⑤的单质中燃烧的产物含量的化学键为离子键、共价键
(5)元素⑦、⑧、⑨的氢化物的稳定性由弱到强的顺序为SiH4<H2S<HCl(填化学式),设计实验证明单质氧化性顺序为⑩>⑧取少量硫化钠溶液于试管中,滴加溴水,试管中出现淡黄色沉淀,证明Br2的氧化性比S的强.
分析 由元素在周期表中的位置,可知⑥为Na、⑦为Si、⑧为S、⑨为Cl、⑩为Br,元素①是常见的过渡元素,其氧化物呈黑色且只有磁性,则①为Fe,②、③化合价分别为+2、+3,分别处于ⅡA、ⅢA族,原子半径相近,二者同周期,由化合价可知,④为ⅤA族元素、⑤为ⅥA族元素,④⑤原子半径相近,二者同周期,且与②③原子半径相差较大,故②③处于第三周期,④⑤处于第二周期,故②为Mg、③为Al、④为N、⑤为O,据此解答.
解答 解:由元素在周期表中的位置,可知⑥为Na、⑦为Si、⑧为S、⑨为Cl、⑩为Br,元素①是常见的过渡元素,其氧化物呈黑色且只有磁性,则①为Fe,②、③化合价分别为+2、+3,分别处于ⅡA、ⅢA族,原子半径相近,二者同周期,由化合价可知,④为ⅤA族元素、⑤为ⅥA族元素,④⑤原子半径相近,二者同周期,且与②③原子半径相差较大,故②③处于第三周期,④⑤处于第二周期,故②为Mg、③为Al、④为N、⑤为O.
(1)元素⑩的名称是:溴;元素⑤的简单离子为O2-,结构示意图是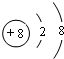 ;所给元素中,其含氧化合物能用于漂白,SO2、HClO具有漂白性,该元素可能是S、Cl,
;所给元素中,其含氧化合物能用于漂白,SO2、HClO具有漂白性,该元素可能是S、Cl,
故答案为:溴;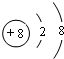 ;S、Cl;
;S、Cl;
(2)元素④为N元素,在周期表中的位置是:第二周期VA族,该元素的氢化物与元素⑤的单质在高温催化剂条件下反应的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:第二周期VA族;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)金属性Na>Mg>Al,故离子的氧化性由强到弱的顺序为Al3+>Mg2+>Na+,元素③的单质与元素①的磁性氧化物高温条件下发生反应的化学方程式为:3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Al+4Al2O3,
故答案为:Al3+>Mg2+>Na+;3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Al+4Al2O3;
(4)元素⑥为Na,焰色反应为黄色,该元素的单质在元素⑤的单质中燃烧的产物为Na2O2,含有离子键、共价键,
故答案为:黄色;离子键、共价键;
(5)非金属性Si<S<Cl,故氢化物的稳定性由弱到强的顺序为SiH4<H2S<HCl,利用单质之间的相互置换可以证明单质氧化性,具体方案为:取少量硫化钠溶液于试管中,滴加溴水,试管中出现淡黄色沉淀,证明Br2的氧化性比S的强,
故答案为:SiH4<H2S<HCl;取少量硫化钠溶液于试管中,滴加溴水,试管中出现淡黄色沉淀,证明Br2的氧化性比S的强.
点评 本题考查元素周期表与元素周期律,注意根据化合价与原子半径推断元素,注意金属性、非金属性强弱比较实验事实.

| A. |  2-乙基丙烷 | B. | 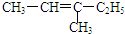 3-甲基-3-戊烯 | C. | 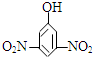 2,4-二硝基苯酚 | D. | 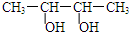 2,3-丁二醇 |
| A. | O2与O3 | B. | CH3CH2OH与CH3CH2-O-CH2CH3 | ||
| C. | ${\;}_{6}^{12}$C与${\;}_{6}^{13}$C | D. | CH3CH2CH2CH3与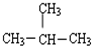 |
| A. | 铜制水龙头 | B. | 铁制水龙头 | C. | 塑料水龙头 | D. | 陶瓷水龙头 |
| A. | 一定温度下,反应2H2O(l)═2H2(g)+O2(g)的△H>0△S>0 | |
| B. | 水解反应NH4++H2O?NH3•H2O+H+达到平衡后,升高温度平衡逆向移动 | |
| C. | 对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 | |
| D. | AgCl悬浊液中存在平衡:AgCl(s)?Ag+(aq)+Cl-(aq),往其中加入少量NaCl晶体,平衡逆向移动,Ksp减小 |
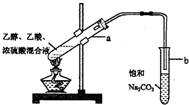
| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加入乙酸 | |
| B. | 饱和碳酸钠溶液可以除去乙酸乙酯中混有的乙酸 | |
| C. | 向a试管中加入几块碎瓷片的作用是防止加热时液体暴沸 | |
| D. | 将制得的乙酸乙酯分离出来,应采用“分液”的实验操作 |
| A. | 氢氧化钡溶液与硫酸镁溶液反应:Ba2++SO42-═BaSO4↓ | |
| B. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 硫酸铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 铁屑与足量稀硝酸反应:Fe+2H+═Fe2++H2↑ |
| A. | 将钠粒投入CuSO4溶液中:2Na+Cu2+═Cu+2Na+ | |
| B. | 将NaHSO4溶液滴加到含有酚酞的Ba(OH)2溶液中,溶液由红色变成无色:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 硫化钠溶液中加入少量的氯化铁溶液:S2-+2Fe3+═2Fe2++S↓ | |
| D. | 将少量醋酸加入到NaAlO2溶液中:CH3COOH+AlO2-+H2O═CH3COO-+Al(OH)3↓ |
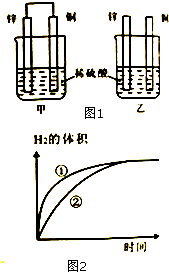 将锌片和铜片按如图1所示方式插入100mL相同浓度的稀硫酸中,某化学兴趣小组探究化学能与电能的相互转化,回答:
将锌片和铜片按如图1所示方式插入100mL相同浓度的稀硫酸中,某化学兴趣小组探究化学能与电能的相互转化,回答: