题目内容
15.合成氨的反应进行到2秒时,氨气的浓度增加了0.6mol/L.用氮气的浓度变化表示该时间段的反应速率为( )| A. | 0.15 mol/(L•S) | B. | 0.3 mol/(L•S) | C. | 0.6 mol/(L•S) | D. | 0.9 mol/(L•S) |
分析 根据v=$\frac{△c}{△t}$计算v(NH3),再利用速率之比等于化学计量数之比计算利用氮气表示的化学反应速率.
解答 解:v(NH3)=$\frac{0.6mol/L}{2s}$=0.3mol/(L•s),故利用氮气表示的化学反应速率为:v(N2)=$\frac{1}{2}$v(NH3)=0.15mol/(L•S),故选A.
点评 本题考查反应速率的有关计算,难度较小,旨在考查学生对基础知识的掌握,注意公式的运用.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
5.下列四个选项是在不同的情况下对化学反应3A(g)+B(g)?2C(g)+2D(g)测得的用不同物质表示的反应速率,其中表示该化学反应的反应速率最快的是( )
| A. | v(D)=0.5mol•L-1.s-1 | B. | v(C)=3.0 mol•L-1•min-1 | ||
| C. | v(B)=0.30 mol•L-1.s-1 | D. | v(A)=0.60 mol•L-1.s-1 |
6.下列有机物的系统命名正确的是( )
| A. | 1,4-二甲基丁烷 | B. | 3,3-二甲基丁烷 | ||
| C. | 2-乙基戊烷 | D. | 4-甲基-3-乙基辛烷 |
3.下列各对物质中属于同分异构体的是( )
| A. | O2与O3 | B. | CH3CH2OH与CH3CH2-O-CH2CH3 | ||
| C. | ${\;}_{6}^{12}$C与${\;}_{6}^{13}$C | D. | CH3CH2CH2CH3与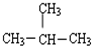 |
10.下列各组物质中,属于同系物的是( )
| A. | 甲醇、乙二醇 | B. | 甲酸乙酯和乙酸甲酯 | ||
| C. | 蚁酸和乙酸 | D. | 苯酚( -OH)和甲苯( -OH)和甲苯( -CH3) -CH3) |
20.镀锌自来水管与下列水龙头连接,连接处自来水管锈蚀最快的是( )
| A. | 铜制水龙头 | B. | 铁制水龙头 | C. | 塑料水龙头 | D. | 陶瓷水龙头 |
7.下列说法不正确的是( )
| A. | 一定温度下,反应2H2O(l)═2H2(g)+O2(g)的△H>0△S>0 | |
| B. | 水解反应NH4++H2O?NH3•H2O+H+达到平衡后,升高温度平衡逆向移动 | |
| C. | 对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 | |
| D. | AgCl悬浊液中存在平衡:AgCl(s)?Ag+(aq)+Cl-(aq),往其中加入少量NaCl晶体,平衡逆向移动,Ksp减小 |
4.在实验室可以用图所示的装置制取乙酸乙酯,下列说法不正确的是( )
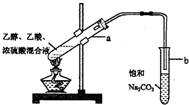

| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加入乙酸 | |
| B. | 饱和碳酸钠溶液可以除去乙酸乙酯中混有的乙酸 | |
| C. | 向a试管中加入几块碎瓷片的作用是防止加热时液体暴沸 | |
| D. | 将制得的乙酸乙酯分离出来,应采用“分液”的实验操作 |
5.已知:①向KClO3晶体中滴加浓盐酸,产生黄绿色气体.②向NaI溶液中通入少量实验①产生的气体,溶液变黄色.③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.下列判断正确的是( )
| A. | 实验①证明KClO3具有还原性 | |
| B. | 实验②中氧化剂与还原剂的物质的量之比为2:1 | |
| C. | 实验③说明KI被氧化 | |
| D. | 上述实验证明氧化性:ClO3->Cl2>I2 |