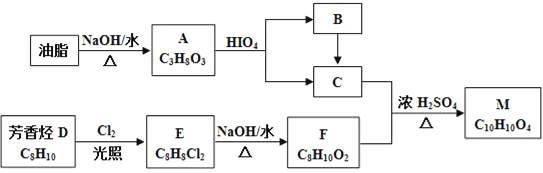
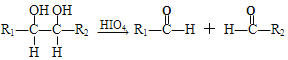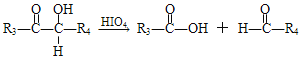��Ŀ����
����Ŀ����ѧ��Ӧ���ʺ���������������������ء�
(1)ijѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯����400mLϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų���������ʵ���¼����(�ۼ�ֵ)��
ʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 |
���������mL������״���� | 100 | 240 | 464 | 576 | 620 |
����һʱ��η�Ӧ�������__min(��0��1��1��2��2��3��3��4��4��5)��ԭ����___��
����3��4����ʱ����������Ũ�ȱ仯����ʾ�ĸ÷�Ӧ����___(����Һ�������)��
(2)��һѧ��Ϊ���Ʒ�Ӧ���ʷ�ֹ��Ӧ�������Բ�������������������������м���������������Һ�Լ�����Ӧ���ʣ�����Ϊ�����е���___��
A.����ˮ B.KCl��ҺC.KNO3��ҺD.CuSO4��Һ
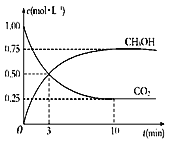
(3)ij�¶�����4L�ܱ������У�X��Y��Z������̬���ʵ����ʵ�����ʱ��仯������ͼ��

�ٸ÷�Ӧ�Ļ�ѧ����ʽ��___��
�ڸ÷�Ӧ�ﵽƽ��״̬�ı�־��___��
A.Y����������ڻ�������б��ֲ���
B.2v(X)=3v(Z)
C.����������ѹǿ���ֲ���
D.X��Y��Z���������Ũ��֮��Ϊ3:1:2
E.����1molY��ͬʱ����2molZ
F.�����������ƽ����Է����������ֲ���
��2min��Y��ת����Ϊ___��
���𰸡�2-3 �÷�Ӧ�Ƿ��ȷ�Ӧ���¶�Խ�ߣ���Ӧ����Խ�� 0.025mol��L-1��min-1 CD 3X(g)+Y(g)2Z(g) ACF 10%
��������
(1)����ͬͨ�����£���Ӧ����Խ����ͬʱ�����ռ�������Խ�ࣻ�ɱ������ݿ�֪����Ӧ��������ʱ�����23min��ԭ���ǣ��÷�Ӧ�Ƿ��ȷ�Ӧ���¶�Խ�ߣ���Ӧ����Խ��
��34����ʱ��Σ��ռ����������=(576464)mL=112mL��n(H2)=![]() =0.005mol������������HCl��ϵʽ�����ĵ�n(HCl)=2n(H2)=2��0.005mol=0.01mol����v(HCl)=
=0.005mol������������HCl��ϵʽ�����ĵ�n(HCl)=2n(H2)=2��0.005mol=0.01mol����v(HCl)=![]() =0.025 mol/(Lmin)��
=0.025 mol/(Lmin)��
(2)A����������ˮ��������Ũ�ȼ�С����Ӧ���ʽ��ͣ���A���У�
B������KCl��Һ��������Ũ�Ƚ��ͣ���Ӧ���ʽ��ͣ���B���У�
C������KNO3��Һ���൱�ں������ᣬ�����Zn��Ӧ����NO��������������C�����У�
D������CuSO4��Һ��Zn��ͭ���ӷ�Ӧ����Cu��Zn��Cu��ϡ���ṹ��ԭ��ض��ӿ췴Ӧ���ʣ���D�����У�
��ѡCD��
(3)�ٸ���ͼ֪�����ŷ�Ӧ���У�X��Y�����ʵ������ٶ�Z�����ʵ������ӣ���X��Y�Ƿ�Ӧ���Z���������Ӧ�ﵽƽ��ʱ����n(X)=(1.00.4)mol=0.6mol����n(Y)=(1.00.8)mol=0.2mol����n(Z)=(0.50.1)mol=0.4mol��ͬһ���淴Ӧ��ͬһ��ʱ���ڲμӷ�Ӧ�ĸ����ʵ����ʵ����仯��֮�ȵ��������֮�ȣ�X��Y��Z�ļ�����֮��=0.6mol��0.2mol��0.4mol=3:1:2����÷�Ӧ����ʽΪ3X+Y2Z��
��A��Y����������ڻ�������б��ֲ��䣬˵�������ʵ������䣬��Ӧ�ﵽƽ��״̬����A�Ƿ�Ӧ�ﵽƽ��״̬�ı�־��
B��2v(X)=3v(Z)��![]() �������Ӧ���ʶ���ָͬһ����ķ�Ӧ���ʣ���÷�Ӧ��һ���ﵽƽ��״̬����B���Ƿ�Ӧ�ﵽƽ��״̬�ı�־��
�������Ӧ���ʶ���ָͬһ����ķ�Ӧ���ʣ���÷�Ӧ��һ���ﵽƽ��״̬����B���Ƿ�Ӧ�ﵽƽ��״̬�ı�־��
C����Ӧǰ������ѹǿ��С��������������ѹǿ���ֲ���ʱ�������ʵ����ʵ������䣬��Ӧ�ﵽƽ��״̬����C�Ƿ�Ӧ�ﵽƽ��״̬�ı�־��
D����Ӧ�ﵽƽ��״̬ʱ����ϵ�и���ֵ�Ũ�Ȳ��ٷ����仯����X��Y��Z���������Ũ��֮��Ϊ3:1:2������˵����Ӧ�ﵽƽ��״̬����D���Ƿ�Ӧ�ﵽƽ��״̬�ı�־��
E������1mol Y��ͬʱ����2molZ������ָͬһ����ķ�Ӧ���ʣ�������Ϊ�жϴﵽƽ��״̬�����ݣ���E���Ƿ�Ӧ�ﵽƽ��״̬�ı�־��
F��ƽ����Է�����������ֵ����ƽ��Ħ������������M=![]() ��������������ѭ�����غ㣬�������������䣬��Ӧǰ����������ʵ����ı䣬��ƽ����Է�������(ƽ��Ħ������)���ֲ���ʱ����Ӧ�ﵽƽ��״̬����F�Ƿ�Ӧ�ﵽƽ��״̬�ı�־��
��������������ѭ�����غ㣬�������������䣬��Ӧǰ����������ʵ����ı䣬��ƽ����Է�������(ƽ��Ħ������)���ֲ���ʱ����Ӧ�ﵽƽ��״̬����F�Ƿ�Ӧ�ﵽƽ��״̬�ı�־��
��ѡACF��
��Y��ת����=![]() ��100%=
��100%=![]() ��100%=10%��
��100%=10%��

 ÿ�α���ϵ�д�
ÿ�α���ϵ�д� ��ѧ����ϵ�д�
��ѧ����ϵ�д�����Ŀ���±��г���A-F6��Ԫ�������ڱ��ж����ڵ�λ�á�
C | D | ||||||
A | B | E | F |
��ش��������⣺
(1)CԪ�������ڱ��е�λ��___��CԪ�ص�һ�����������������壬��������ĵ���ʽΪ��___��
(2)A��B������������Ӧ��ˮ������Խ�ǿ����___��(�ѧʽ)
(3)D��ͬ����һ����Ԫ�ص���̬�⻯��ķе�ϸߵ���___(�ѧʽ)��ԭ����___��
(4)Ԫ��E��Ԫ��F��ȣ��ǽ����Խ�ǿ����___(��Ԫ�ط�����д)�����б�������֤����һ��ʵ����___(�ɶ�ѡ)��
��F���⻯���E���⻯���ȶ�
�ڳ�����F�ĵ��ʺ�E�ĵ���״̬��ͬ
��һ��������F��E�ĵ��ʶ���������������Һ��Ӧ
��F���������ˮ��������Ա�E���������ˮ���������ǿ
��F����E�����⻯��ˮ��Һ���û�����
(5)Ԫ��E��һ��������ͨ���Ȼ�����Һ������ͨ�����ᱵ��Һȴ�������ɫ������д��������������ͨ�����ᱵ��Һ�����ӷ���ʽ___��