题目内容
【题目】下表列出了A-F6种元素在周期表中短周期的位置。
C | D | ||||||
A | B | E | F |
请回答下列问题:
(1)C元素在周期表中的位置___;C元素的一种氧化物是温室气体,该氧化物的电子式为:___。
(2)A和B的最高价氧化物对应的水化物碱性较强的是___;(填化学式)
(3)D与同族下一周期元素的气态氢化物的沸点较高的是___(填化学式),原因是___。
(4)元素E与元素F相比,非金属性较强的是___(用元素符号填写),下列表述中能证明这一事实的是___(可多选)。
①F的氢化物比E的氢化物稳定
②常温下F的单质和E的单质状态不同
③一定条件下F和E的单质都能与氢氧化钠溶液反应
④F的氧化物的水化物的酸性比E的氧化物的水化物的酸性强
⑤F可以把E从其氢化物水溶液中置换出来
(5)元素E的一种氧化物通入氯化钡溶液无沉淀,通入硝酸钡溶液却会产生白色沉淀,写出少量该氧化物通入硝酸钡溶液的离子方程式___。
【答案】第二周期,第IVA族 ![]() NaOH NH3 NH3分子间存在氢键 Cl ①⑤ 3SO2+3Ba2++2NO
NaOH NH3 NH3分子间存在氢键 Cl ①⑤ 3SO2+3Ba2++2NO![]() +2H2O=3BaSO4↓+2NO↑+4H+
+2H2O=3BaSO4↓+2NO↑+4H+
【解析】
根据各元素在元素周期表中的位置可知A为钠元素,B为氯元素,C为碳元素,D为氮元素,E为硫元素,F为氟元素。
(1)C为碳元素,位于第二周期,第IVA族;C元素的一种氧化物是温室气体,该氧化物为CO2,电子式为![]() ;
;
(2)同周期主族元素自左至右金属性减弱,所以Na的金属性强于Al,则NaOH碱性较强;
(3)D为氮元素,同族下一周期元素为P元素,由于NH3分子间存在氢键,所以NH3的沸点较高;
(4)同周期主族元素自左至右非金属性增强,所以Cl的非金属性较强;
①非金属性越强,氢化物越稳定,故①可以证明;
②单质的状态与元素的非金属性强弱无关,故②不能证明;
③S和Cl2均能在NaOH溶液中发生歧化反应,是自身的氧化还原反应,无法比较两种单质的氧化性强弱,无法判断非金属性强弱,故③不能证明;
④非金属性越强,最高价氧化物的水化物的酸性越强,非最高价则不一定,故④不能证明;
⑤Cl2可以把S从H2S溶液中置换出来,说明氯气的氧化性比硫强,非金属性越强单质的氧化性越强,故⑤可以证明;
综上所述选①⑤;
(5)S元素的一种氧化物通入氯化钡溶液无沉淀,通入硝酸钡溶液却会产生白色沉淀,则该氧化物为SO2,由于亚硫酸酸性比盐酸弱,所以不能与氯化钡溶液产生沉淀,通入硝酸钡溶液中被硝酸根氧化成硫酸根,从而生成硫酸钡沉淀,离子方程式为3SO2+3Ba2++2NO![]() +2H2O=3BaSO4↓+2NO↑+4H+。
+2H2O=3BaSO4↓+2NO↑+4H+。

【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
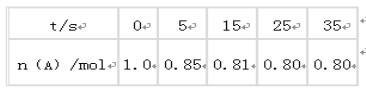
①哪一时间段反应速率最大__min(填0~1、1~2、2~3、3~4、4~5),原因是___。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率___(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是___。
A.蒸馏水 B.KCl溶液C.KNO3溶液D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。

①该反应的化学方程式是___。
②该反应达到平衡状态的标志是___。
A.Y的体积分数在混合气体中保持不变
B.2v(X)=3v(Z)
C.容器内气体压强保持不变
D.X、Y、Z三种气体的浓度之比为3:1:2
E.生成1molY的同时消耗2molZ
F.容器内气体的平均相对分子质量保持不变
③2min内Y的转化率为___。